سلام دوستان عزیز
در این مطلب می خواهیم نکته ها و حفظیات فصل 1 شیمی دهم از صفحهء 31 تا 38 مطابق با بودجه بندی آزمون 24 دی که برای پاسخگویی به سوالات آزمون باید به آنها مسلط باشید، بپردازیم.
 | دانشجوی مهندسی عمران دانشگاه تهران رتبه 328 منطقه دو - کنکور ریاضی 1398 |
برای ارتباط بیشتر با برترها و رزرو پشتیبان ویژه، پیج کانون برترها را دنبال کنید، همچنین میتونید با شماره ۰۲۱۸۴۵۱ داخلی ۳۱۲۳ تماس بگیرید.
بودجه بندی فصل اول شیمی 1 در کنکور سال های اخیر
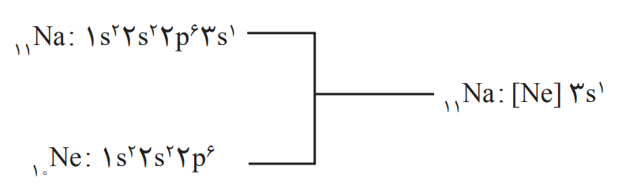
آرایش الكترونی فشرده (شیوۀ دیگر آرایش الکترونی اتم ها):
در این آرایش الكترونی از نماد گاز نجیب استفاده شده است. برای دستیابی به آرایش فشرده، نخست آرایش اتم مورد نظر به صورت گسترده نوشته می شود؛ سپس بخشی از آرایش الكترونی كه همانند آرایش الكترونی یك گاز نجیب است [نماد شیمیایی گاز نجیب] جایگزین می شود. برای مثال:
تعیین موقعیت عنصرها در جدول دوره ای عناصر
با استفاده از آرایش الکترونی عنصار می توان شماره دوره و گروه عنصر را به ترتیب زیر معین کرد.
آ) بزرگترین (n) عدد کوانتومی اصلی در آرایش الکترونی نشنان دهنده ی شماره دوره آن است.
ب) برای تعیین شماره گروه عناصر، سه حالت پیش می آید:
1- اگر عنصر متعلق به دسته (s) باشد، شماره گروه آن برابر با توان (s) است.
2- اگر عنصر متعلق به دسته (p) باشد، شماره گروه آن برابر با (توان 12+ p) است.
3- اگر عنصر متعلق به دسته (d) باشد، شماره گروه آن برابر با (توان d + توان s) است.
توجه: قاعدهء آفبا الکترونی اغلب عنصرها را پیش بینی می کند، اما داده های طیف سنجی نشان می دهد که آرایش الکترونی برخی از اتم ها از قاعدهء آفبا پیروی نمی کند؛ به طور مثال هر یک از اتم های کروم (24Cr) و مس (29Cu) در بیرونی ترین زیرلایهء خود تنها یک الکترون دارند. شما باید این دو استثناء را در آرایش الکترونی اتم عنصرهای دورهء چهارم بلد باشید.


نکته: با توجه به این که آخرین الکترون وارد شده به اتم، در کدام زیرلایه قرار می گیرد، عناصر در چهار دسته ی S، P، d، f، جای می گیرند و تعداد الکترون های ظرفیت این عناصر (به جز دسته ی f) به صورت زیر است:
نکته: لایه طرفیت، بیرونی ترین لایه ی اتم و لایه ای است که الکترون های آن، رفتار شیمیایی اتم را تعیین می کند.
گازهای نجیب
1. در طبیعت به شكل تك اتمی یافت می شوند.
2. واكنش ناپذیر بوده یا واكنش پذیری بسیار كمی دارند، از این رو پایدارند.
3. در لایه ی ظرفیت این اتم ها، هشت الكترون وجود دارد (به جز هلیم كه در تنها لایه ی الكترونی خود، دو الكترون دارد).
آرایش الکترون – نقطه ای عناصر هم گروه با هم یکسان است. ( به جز گروه 18 که آرایش الکترون نقطه He با سایر عناصر گروه متفاوت است.)
توجه کنید که در آرایش He، 2 الکترون باید به صورت جفت نمایش داده شوند، نه تکی.
بیش ترین تعداد الکترون های تکی مربوط به گروه 14 جدول دوره ای هستند.
تست ها:
1- چند مورد از مطالب زیر، نادرست اند؟
•یکی از زیرلایه های موجود در لایهء الکترونی سوم، در عنصرهای دورهء چهارم جدول شروع به پرشدن می کند.
•زیرلایه ای که مجموع n+l آن برابر یک است، در عنصرهای دورهء اول جدول پر می شود.
•در عنصرهای دورهء چهارم جدول، زیرلایه های s4، p4، d4 و f4 در حال پرشدن هستند.
•ترتیب پرشدن زیرلایه های p6، s6، f4، d5 به صورت s6 ← f4 ← d5 ← p6 است.
1) 1 2) 2 3) 3 4) 3
2- اگر تفاوت شمار نوترون ها و الکترون ها در یون تک اتمی +4A119، برابر 23 باشد، عنصر A در کدام گروه و کدام دورهء جدول تناوبی جای دارد؟
1) 14 – چهارم 2) 15 – پنجم 3) 16 – چهارم 4) 14 - پنجم
دوستان عزیز می توانید برای دسترسی به نسخه کامل خلاصه نکات به همراه پاسخ فایل، پی دی اف زیر را دانلود کنید!
فراموش نکنید اگر سوالی در رابطه با این مبحث داشتید می توانید به راحتی در کامنت ها سوال خود را برای ما بنویسید.
برای ارتباط با رتبه برترها صفحه اینستاگرام زیر رو دنبال کنید.
با آرزوی موفقیت و کامیابی



