سلام دوستان عزیز!
در این مطلب میخواهیم با هم به جمع بندی فصل دوم شیمی یازدهم و هم چنین خلاصه نکاتی که برای پاسخگویی به سوالات آزمون باید به آنها مسلط باشید، بپردازیم.
 | دانشجوی مهندسی عمران دانشگاه تهران رتبه 328 منطقه دو - کنکور ریاضی 1398 |
برای ارتباط بیشتر با برترها و رزرو پشتیبان ویژه، پیج کانون برترها را دنبال کنید، همچنین میتونید با شماره ۰۲۱۸۴۵۱ داخلی ۳۱۲۳ تماس بگیرید.
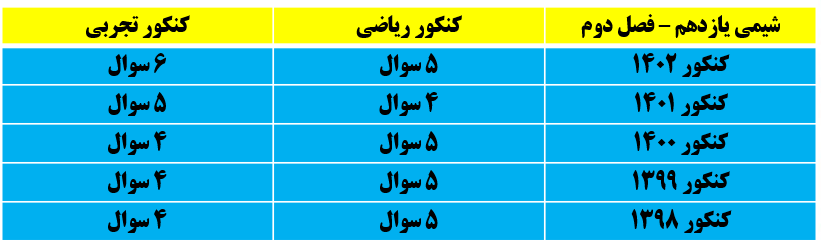
بودجه بندی فصل دوم در کنکور سال های اخیر
مفهوم آنتالپی
انرژی کل یک سامانه هم ارز با محتوی انرژی یا آنتالپی آن می باشد. بنابراین هر سامانه در دما و فشار ثابت آنتالپی معینی دارد.
در واکنش های گرماگیر مواد با آنتالپی کم تر به مواد با آنتالپی بیش تر تبدیل می شوند.
در واکنش های گرماده مواد با آنتالپی بیش تر به مواد با آنتالپی کم تر تبدیل می شوند.
انجام واکنش همراه با داد و ستد انرژی در واکنش ها همراه است که این انرژی به شکل گرما ظاهر می شود. تغییر آنتالپی هر واکنش هم ارز با گرمایی است که در فشار ثابت با محیط مبادله می شود و با Q_P نمایش داده می شود.
∆H=H(ها فرآورده)-H(ها دهنده واکنش)=Q_P
واکنش های گرماده:H_(ها دهنده واکنش)>H_( ها فرآورده)→∆H<0
واکنش های گرماگیر:H_(ها دهنده واکنش)0
نکته: واکنش های رفت و برگشت قرینه یکدیگر هستند.
استوکیومتری∆H
برای محاسبه مقدار گرمای خواسته شده ابتدا مقدار ماده را به مول تبدیل می کنیم سپس با استفاده از کسر تبدیل مناسب مقدار مول را به گرما (کیلوژول) تبدیل می کنیم.
آنتالپی پیوند و میانگین آن
به مقدار انرژی لازم برای شکستن یک مول از پیوند های اشتراکی در حالت گازی و تبدیل آن ها به اتم های سازنده گازی شکل، آنتالپی پیوند گفته می شود. به عنوان مثال برای شکستن پیوندهای موجود در یک مول (H2)g و تبدیل آن به دو مول اتم هیدروژن گازیkJ ٤٣٦ انرژی لازم است.
بنابراین از آنجا که شکستن یک پیوند همواره گرماگیر است آنتالپی آن همیشه مثبت است.
نکته: در مولکول هایی مانند NH3، CH4، H2O که اتم مرکزی در آن ها به چند اتم یکسان با پیوند اشتراکی متصل است. از واژه میانگین آنتالپی پیوند استفاده می شود چون انرژی لازم برای شکستن این پیوند ها یکسان نیست.
نکته: آنتالپی واکنش تشکیل پیوند قرینه آنتالپی پیوند است.
نکته: آنتالپی پیوند های متفاوت به دو عامل وابسته است:
1) مرتبه پیوند (تعداد پیوند های بین دو اتم): هر چه مرتبه پیوند بیش تر باشد، انرژی پیوند بیش تر است.
2) شعاع اتم های تشکیل دهنده پیوند: هرچه شعاع اتم های تشکیل دهنده پیوند بیش تر باشد، آنتالپی پیوند کوچک تر است. نکته: هم چنین در یک پیوند هرچه اختلاف الکترونگاتیوی بین دو اتم بیش تر باشد قطبیت پیوند بیش تر شده و جاذبه بین دو اتم قوی تر می شود لذا انرژی پیوند افزایش می یابد.
نکته: در اندازه گیری آنتالپی پیوند، همه مواد (واکنش دهنده ها و فراورده ها) باید گازی شکل باشند زیرا اگر ماده اولیه در حالت جامد یا مایع باشد باید مقداری انرژی صرف غلبه بر نیروهای بین ذره ای آن کرد. به عبارت دیگر مقداری انرژی صرف تبخیر یا ذوب آن ماده می شود که این امر اندازه گیری آنتالپی پیوند را دچار خطا می کند.
آنتالپی پیوند، برای محاسبه تغییرات آنتالپی واکنش
∆_واکنش=( شده شکسته های پیوند مجموع)-(شده تشکیل های پیوند آنتالپی مجموع)
آنتالپی سوختن:
سوختن تغییر شیمیایی است که طی آن یک ماده به سرعت واکنش می دهد و انرژی زیادی به صورت گرما آزاد می کند. آنتالپی واکنشی را که در آن یک مول از ماده در مقدار اکسیژن کافی بسوزد، آنتالپی سوختن آن ماده می نامند که دارای واحد کیلوژول بر مول و علامت منفی است.
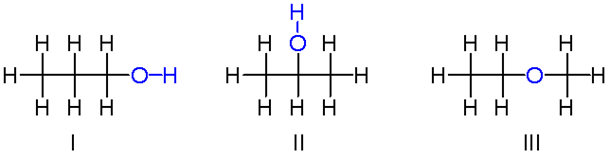
نکته: یکی از فرآورده های سوختن مواد آلی به صورت H2O است که به صورت مایع است.
نکته: هر چه جرم هیدروکربنی بیش تر باشد، گرمای حاصل از سوختن آن بیش تر است.
نکته: گرمای حاصل از سوختن آلکان ها از الکل های هم کربن خودشان بیش تر است.
نکات حفظی:
1- سوخت های سبز در ساختار خود علاوه بر هیدروژن و کربن، اکسیژن نیز دارند و از پسماند های گیاهی مانند سویا، نیشکر و دیگر دانه های روغنی اسخراج می شوند. بنابراین اتانول نیز سوخت سبز به شمار می رود.
2- هرگاه بدن نیاز فوری به انرژی داشته باشد، مصرف موادی که کربوهیدرات زیادی دارند، توصیه می شود.
3- هرگاه بدن برای انجام فعالیت های فیزیکی در مدت طولانی نیاز به انرژی داشته باشد مصرف موادی که چربی بیشتری دارند توصیه می شود.


غذای سالم و آهنگ واکنش:
شرایط زیر فساد مواد غذایی را به تاخیر می اندازد و ماندگاری را افزایش می دهد:
محیط سرد، محیط خشک، محیط تاریک و حذف اکسیژن از محیط
آهنگ واکنش:
آهنگ واکنش کمیتی است که نشان می دهد هر تغییر شیمیایی در چه مدت زمانی انجام می شود؛ هرچه مدت زمان انجام یک واکنش کم تر باشد، آهنگ انجام آن تند تر است و واکنش سریع تر انجام می شود.
شیمی دان ها آهنگ انجام واکنش را در گسترهء معینی از زمان به نام سرعت واکنش بیان می کنند. زمان انجام واکنش ها می تواند گستره ای از چند صدم ثانبه تا چند سده را در بر گیرد.
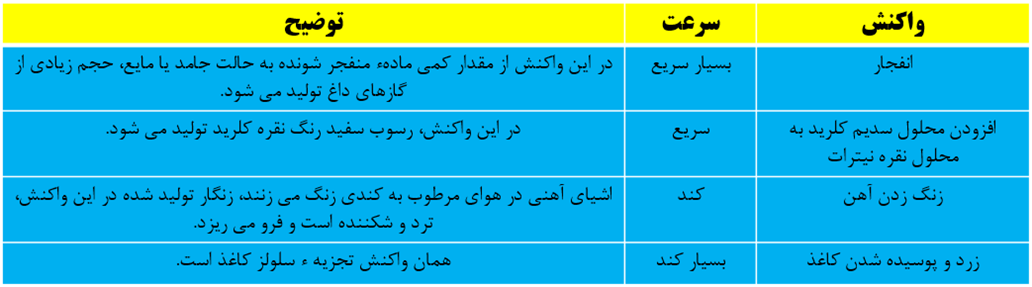

نکته: کاتالیزگر ماده ای است که سرعت واکنش شیمیایی را افزایش می دهند ولی خود مصرف نمی شود. مثلا حضور کاتالیزگر KI سبب تسریع تجزیه شدن هیدورژن پراکسید در دمای اتاق می شود.
نکته: هرچه سطح جامدات کوچک تر باشد سرعت انجام واکنش بیش تر است.
نکته: در برخی واکنش های تغییر غلظت تاثیری بر سرعت واکنش ندارد.
نکته: در واکنش هایی که حداقل یکی از واکنش دهنده ها گازی باشد تغییر فشار، سرعت انجام واکنش را تغییر خواهد داد.
نکته: افزایش دما سبب افزایش انرژی ذرات و طبیعتا افزایش سرعت انجام واکنش می شود.
نکته: افزودن کاتالیزگر سبب افزایش مقدار فرآورده نمی شود بلکه همان مقدار فرآورده با سرعت بیش تر و در زمان کوتاه تری تولید می شود.
نکته: نگهدارنده ها سرعت واکنش های شیمیایی را که منجر به فساد می شود، کاهش می دهند. یکی از این مواد بنزوییک اسید است که در توت فرنگی و تمشک موجود است.
سرعت واکنش: اگر سرعت تولید یا مصرف هر یک از مواد شرکت کننده در واکنش را بر ضریب استوکیومتری آن ماده تقسیم کنیم، سرعت متوسط واکنش حاصل می شود.
سرعت متوسط واکنش گازی: aA → bB
از رابطه زیر به دست می آید:
در یک واکنش، سرعت مصرف واکنش دهنده ها و سرعت تولید فرآورده ها هر دو با گذشت زمان کاهش می یابند؛ زیرا در یک واکنش به تدریج با مصرف واکنش دهنده ها غلظت آن ها کم شده و سرعت واکنش کاهش می یابد. از طرفی سرعت تولید فرآورده ها نیز تابع سرعت مصرف واکنش دهنده ها است؛ بنابراین سرعت تولید فرآورده ها نیز کاهش می یابد.
در یک واکنش، نمودار، «مول یا غلظت – زمان» مربوط به فرآورده ها صعودی و نمودار «مول یا غلظت – زمان» مربوط به واکنش دهنده ها نزولی است.

کنکور سراسری تجربی 1401

کنکور سراسری تجربی 1401

کنکور سراسری تجربی 1401

کنکور سراسری ریاضی 1401

کنکور سراسری ریاضی 1402
دوستان عزیز می توانید برای دسترسی به نسخه کامل به همراه پاسخ فایل، پی دی اف زیر را دانلود کنید!
دوستان عزیزم؛ برای ارتباط با رتبه برترها صفحه تلگرام زیر رو دنبال کنید.
با آرزوی موفقیت و کامیابی



