سلام دوستان عزیز
در این مطلب می خواهیم به جمع بندی خلاصه نکات و حفظیات صفحات 63 تا 77 شیمی یازدهم مطابق با بودجه بندی آزمون 6 اسفند که برای پاسخگویی به سوالات آزمون باید به آنها مسلط باشید، بپردازیم.
| دانشجوی مهندسی عمران دانشگاه تهران رتبه 328 منطقه دو - کنکور ریاضی 1398 |
برای ارتباط بیشتر با برترها و رزرو پشتیبان ویژه، پیج کانون برترها را دنبال کنید، همچنین میتونید با شماره ۰۲۱۸۴۵۱ داخلی ۳۱۲۳ تماس بگیرید.
بودجه بندی فصل دوم در کنکور سال های اخیر
مبادله گرما بر اثر انجام واکنش در دمای ثابت
اگر یک واکنش در دمای ثابت انجام شود، یعنی دمای مواد واکنش دهنده پیش از آغاز واکنش با دمای مواد فراورده پس از پایان واکنش برابر باشد، باز هم میان سامانه واکنش و محیط پیرامون، گرما دادوستد خواهد شد. شیمیدان ها گرمای جذب یا آزاد شده در هر واکنش شیمیایی را به طور عمده وابسته به تفاوت میان انرژی پتانسیل مواد واکنش دهنده و فراورده می دانند. انرژی پتانسیل یک نمونه ماده، انرژی نهفته در آن بوده و هم ارز با انرژی ناشی از نیروهای نگهدارنده ذره های سازنده آن است.
•گرمای جذب یا آزاد شده در واکنشی که در دمای ثابت انجام می شود، ناشی از تفاوت انرژی گرمایی (مجموع انرژی جنبشی ذره ها) در مواد واکنش دهنده و فراورده نیست؛ زیرا در دمای ثابت، تفاوت چشمگیری میان انرژی گرمایی آنها وجود ندارد.
•با انجام یک واکنش شیمیایی، شیوه اتصال اتم ها به یکدیگر تغییر می کند و همین امر باعث تفاوت آشکاری در انرژی پتانسیل وابسته به آنها شده و این تفاوت انرژی، در واکنش به شکل گرما ظاهر می شود.
• الماس و گرافیت دو دگرشکل (آلوتروپ) معروف کربن هستند. شیوه اتصال اتم های کربن به یکدیگر در این دو آلوتروپ متفاوت است؛
عوامل موثر بر گرمای واکنش
1- نوع مواد واکنش دهنده و فرآورده: هر ماده در دما و فشار ثابت، انرژی معینی دارد، یعنی سطح انرژی مواد با هم متفاوت است؛ بنابراین گرمای واکنش ها با تغییر نوع ماده، تغییر می کند.
2- دما و فشار: سطح انرژی مواد به دما و فشار بستگی دارد؛ بنابراین برای تعیین گرمای یک واکنش، باید واکنش مورد نظر در یک فشار معین و دمای ثابت انجام شود.
3- مقدار واکنش دهنده ها: هر چه مقدار مواد واکنش دهنده بیشتر باشد، مقدار گرمای مبادله شده نیز بیشتر خواهد بود.
4- حالت فیزیکی واکنش دهنده ها و فرآورده ها: حالت فیزیکی مواد شرکت کننده در یک واکنش باید مشخص باشد، زیرا انرژی مواد در حالت های فیزیکی مختلف، متفاوت است. به طور کلی سطح انرژی یک ماده در حالت گاز بیشتر از حالت مایع و آن هم بیشتر از حالت جامد می باشد.
جامد < مایع < گاز : سطح انرژی یک ماده در حالت های فیزیکی مختلف
مفهوم آنتالپی
انرژی کل یک سامانه هم ارز با محتوی انرژی یا آنتالپی آن می باشد. بنابراین هر سامانه در دما و فشار ثابت آنتالپی معینی دارد.
در واکنش های گرماگیر مواد با آنتالپی کم تر به مواد با آنتالپی بیش تر تبدیل می شوند.
در واکنش های گرماده مواد با آنتالپی بیش تر به مواد با آنتالپی کم تر تبدیل می شوند.
انجام واکنش همراه با داد و ستد انرژی در واکنش ها همراه است که این انرژی به شکل گرما ظاهر می شود. تغییر آنتالپی هر واکنش هم ارز با گرمایی است که در فشار ثابت با محیط مبادله می شود و با QP نمایش داده می شود.

نکته: واکنش های رفت و برگشت قرینه یکدیگر هستند.
استوکیومتریH∆
برای محاسبه مقدار گرمای خواسته شده ابتدا مقدار ماده را به مول تبدیل می کنیم سپس با استفاده از کسر تبدیل مناسب مقدار مول را به گرما (کیلوژول) تبدیل می کنیم.
نکته: آنتالپی واکنش تشکیل پیوند قرینه آنتالپی پیوند است.
نکته: آنتالپی پیوند های متفاوت به دو عامل وابسته است:
1) مرتبه پیوند (تعداد پیوند های بین دو اتم): هر چه مرتبه پیوند بیش تر باشد، انرژی پیوند بیش تر است.
2) شعاع اتم های تشکیل دهنده پیوند: هرچه شعاع اتم های تشکیل دهنده پیوند بیش تر باشد، آنتالپی پیوند کوچک تر است. نکته: هم چنین در یک پیوند هرچه اختلاف الکترونگاتیوی بین دو اتم بیش تر باشد قطبیت پیوند بیش تر شده و جاذبه بین دو اتم قوی تر می شود لذا انرژی پیوند افزایش می یابد.
نکته: در اندازه گیری آنتالپی پیوند، همه مواد (واکنش دهنده ها و فراورده ها) باید گازی شکل باشند زیرا اگر ماده اولیه در حالت جامد یا مایع باشد باید مقداری انرژی صرف غلبه بر نیروهای بین ذره ای آن کرد. به عبارت دیگر مقداری انرژی صرف تبخیر یا ذوب آن ماده می شود که این امر اندازه گیری آنتالپی پیوند را دچار خطا می کند.
آنتالپی سوختن:
سوختن تغییر شیمیایی است که طی آن یک ماده به سرعت واکنش می دهد و انرژی زیادی به صورت گرما آزاد می کند. آنتالپی واکنشی را که در آن یک مول از ماده در مقدار اکسیژن کافی بسوزد، آنتالپی سوختن آن ماده می نامند که دارای واحد کیلوژول بر مول و علامت منفی است.
نکته: یکی از فرآورده های سوختن مواد آلی به صورت H2O است که به صورت مایع است.
نکته: هر چه جرم هیدروکربنی بیش تر باشد، گرمای حاصل از سوختن آن بیش تر است.
نکته: گرمای حاصل از سوختن آلکان ها از الکل های هم کربن خودشان بیش تر است.
نکات حفظی:
1- سوخت های سبز در ساختار خود علاوه بر هیدروژن و کربن، اکسیژن نیز دارند و از پسماند های گیاهی مانند سویا، نیشکر و دیگر دانه های روغنی اسخراج می شوند. بنابراین اتانول نیز سوخت سبز به شمار می رود.
2- هرگاه بدن نیاز فوری به انرژی داشته باشد، مصرف موادی که کربوهیدرات زیادی دارند، توصیه می شود.
3- هرگاه بدن برای انجام فعالیت های فیزیکی در مدت طولانی نیاز به انرژی داشته باشد مصرف موادی که چربی بیشتری دارند توصیه می شود.
گرمای آزاد شده یا جذب شده در فرآیند های فیزیکی و شیمیایی به دو روش غیر مستقیم و مستقیم قابل اندازه گیری است.
روش مستقیم: در این روش از دستگاهی به نام گرماسنج استفاده می شود، مقدار معینی از واکنش دهنده ها در شرایط مناسب بر هم اثر می دهند و گرمای مبادله شده در واکنش را بطور مستقیم اندازه گیری می کنند. گرماسنج لیوانی نمونه ساده ای از یک گرماسنج است که از دو لیوان یک بار مصرف که عایق گرما هستند ساخته شده و دارای درپوش یونولیتی است. ( در آن دماسنج و همزن هم تعبیه شده است.)
در این سامانه ابتدا مقدار معینی آب یا محلول ریخته و دمای ابتدایی آن تعیین می شود. پس از افزودن ماده دوم به آن و انجام واکنش دمای پایانی و در پی آن تغییر دما مشخص می شود.
در نهایت با استفاده از جرم مواد و گرمای ویژه آن ها و با استفاده از رابطه Q=mc∆T مقدار گرمای واکنش به ازای مقدار معینی ماده محاسبه می شود.
این گرماسنج گرمای واکنش را در فشار ثابت اندازه گیری می کند در نتیجه گرمای بدست آمده همان تغییر آنتالپی است.
روش غیر مستقیم: آنتالپی بسیاری از واکنش ها را نمی توان به روش مستقیم اندازه گیری کرد، زیرا برخی از آن ها مرحله ای از یک واکنش پیچیده هستند. به همین دلیل از روش های غیر مستقیم استفاده می شود که یکی از آن ها قانون هس می باشد.
اساس این روش بر آن است که گرمای واکنش به مسیر انجام واکنش بستگی ندارد، در نتیجه اگر بتوان واکنشی را از جمع دو یا چند واکنش دیگر بدست آورد، تغییر آنتالپی آن نیز جمع تغییرات آنتالپی واکنش ها است.
نکته: با ضرب کردن یک واکنش در عددی آنتالپی آن نیز در همان عدد ضرب می شود.
نکته: با قرینه کردن یک واکنش، آنتالپی آن نیز قرینه می شود.
گروه های عاملی مهم اکسیژن دار
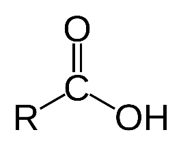
گروه کربونیل
این گروه عاملی مختص آلدهید ها و کتون هاست. در آلدهید ها این گروه عاملی در ابتدای زنجیره کربنی قرار می گیرد و از یک سمت حتما به H متصل است. مانند بنزآلدهید. ولی در کتون ها این گروه عاملی از هر دو سمت به کربن متصل است.

گروه هیدروکسیل
این گروه عاملی مختص الکل ها است. مانند ترکیب آلی موجود در گشنیز که سبب طعم و بوی آن می شود.
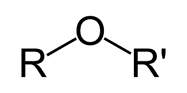
گروه اتری
این گروه مختص اتر هاست. مانند ترکیب آلی موجود در رازیانه که موجب ایجاد طعم و بوی آن می شود.
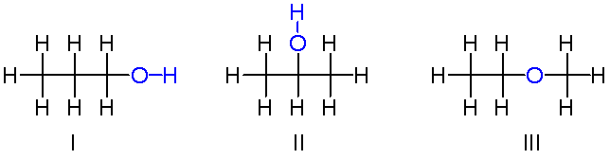
ایزومر
به موادی که فرمول مولکولی یکسان ولی ساختار متفاوتی دارند، ایزومر یا هم پار گفته می شود.
ایزومر ها دارای خواص فیزیکی و شیمیایی متفاوتی هستند و محتوی انرژی آن ها نیز با هم متفاوت است.
نکته: آلدهید ها و کتون های سیر شده و هم کربن ایزومر هستند.
نکته: الکل ها و اترهای سیر شده و هم کربن نیز ایزومر هستند.
غذای سالم و آهنگ واکنش:
شرایط زیر فساد مواد غذایی را به تاخیر می اندازد و ماندگاری را افزایش می دهد:
محیط سرد، محیط خشک، محیط تاریک و حذف اکسیژن از محیط
تست ها
تست1: (متوسط – آزمون کانون قلم چی 98)

تست2: (سخت – سراسری تجربی 91)

تست3: (ساده – آزمون کانون قلم چی 98)

تست4: (سخت – آزمون کانون قلم چی 98)

تست 5: (سخت – آزمون کانون قلم چی 97)

دوستان عزیز می توانید برای دسترسی به نسخه کامل خلاصه نکات به همراه پاسخ، فایل پی دی اف زیر را دانلود کنید!
فراموش نکنید اگر سوالی در رابطه با این مبحث داشتید می توانید به راحتی در کامنت ها سوال خود را برای ما بنویسید.
دوستان عزیزم؛ برای ارتباط با رتبه برترها صفحه اینستاگرام زیر رو دنبال کنید.
با آرزوی موفقیت و کامیابی




