سلام
در این مطلب میخواهیم با هم به جمع بندی نکات شیمی 1 از صفحه 24 تا 44 (مطابق با آزمون) و خلاصه نکات که برای پاسخگویی به سوالات آزمون باید به آنها مسلط باشید، بپردازیم.
نوید آرمات، دانشجوی مهندسی عمران دانشگاه تهران
سیده محدثه حسینی، دانشجوی دکتری تخصصی پیوسته بیوتکنولوژی دانشگاه تهران
مدل کوانتومی اتم:
1- در این مدل اتم مانند کره ای در نظر گرفته می شود که هسته در فضایی بسیار کوچک در مرکز آن قرار دارد.
2- الکترون ها در فضایی بسیار بزرگ تر و در لایه هایی اطرف هسته توزیع می شود.
(لایه ها به ترتیب از طرف هسته به بیرون با شماره های 1، 2 و ... شماره گذاری می شوند.)
3- شماره هر لایه با (n) عدد کوانتومی اصلی، نمایش داده می شود.
4- در ساختار لایه ای، بخش های پررنگ تر، مهم ترین بخش از یک لایه را نشان می دهند که الکترون بیش تر وقت خود را در آن فاصله سپری میکند. (الکترون ها مابقی وقت خود را می توانند در همه ی نقاط پیرامون هسته حضور داشته باشند.)
5- در این مدل، داد و ستد انرژی به صورت کوانتومی صورت می گیرد. یعنی الکترون هنگام انتقال از یک لایه به لایه دیگر انرژی را به صورت پیمانه ای یا بسته ای جذب یا نشر می کند.
توجه : کوانتومی بودن داد و ستد انرژی به معنای « پله پله بودن » آن است. یعنی الکترون نمی تواند به هنگام بالا رفتن و پایین آمدن از لایه ها در هر جایی قرار بگیرد و فقط می تواند بر روی لایه قرار گیرد، آن هم با جذب و یا نشر مقدار انرژی معین و کافی!!
نکته: از آن جا که انرژی داد و ستد شده هنگام انتقال الکترون ها کوانتومی است، ساختار لایه ای اتم را مدل کوانتومی نیز نامیده اند.
نکته: هر چه میزان انرژی جذب شده بیش تر باشد، الکترون به لایه های بالاتر می رود و به هنگام بازگشت انرژی بیشتری آزاد می کند.
بر اساس این مدل:
الکترون در هر لایه، آرایش و انرژی معینی ( نه هر مقدار دلخواهی) دارند و اتم پایداری نسبی دارد. این حالت اتم راحالت پایه می نامند.
انرژی الکترون ها با افزایش فاصله از هسته بیشتر می شود و الکترون ها با گرفتن انرژی به لایه های بالاتر (به صورت پیمانه ای) انتقال می یابند. یعنی به حالت اتم های برانگیخته در می آیند.
اتم های برانگیخته ناپایدارند، از این رو دوباره با از دست دادن انرژی ( به صورت نشر نور که مناسب ترین شیوه است) به حالت پایه باز می گردند.
توزیع الکترون ها در لایه ها و زیر لایه ها
همانطور که در بخش قبلی آموختید، اتم ساختار لایه ای دارد و این لایه ها با عدد کوانتومی اصلی(n) نشان داده می شوند که مقادیر ان می تواند از n=1,2,…,7 باشد.
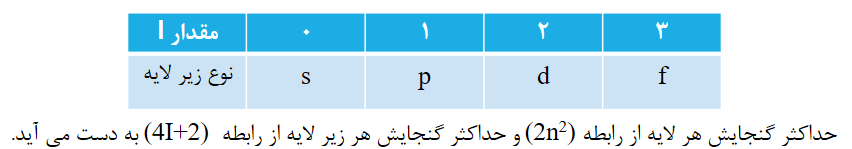
در مدل کوانتومی اتم، به هر نوع زیر لایه، عدد کوانتومی خاصی نسبت می دهند که با I نشان داده می شود و عدد کوانتومی فرعی نامیده می شود.
برای هر یک از مقادیر عددیI ، معمولا حروف در نظر گرفته می شود که به صورت جدول زیر است:
قاعده ی آفبا
روند پر شدن زیرلایه ها در اطرف هسته تنها به عدد کوانتومی اصلی وابسته نیست بلکه از قاعده کلی به نام آفبا پیروی می کند.
بر طبق این قاعده، هنگام افزودن الکترون به زیرلایه ها، نخست زیرلایه های نزدیک تر به هسته پر می شوند که دارای انرژی کم تری هستند و سپس زیرلایه های بالاتر پر خواهند شد.
ترتیب پر شدن زیرلایه ها به صورت مقابل است:
1s → 2s → 2p → 3s → 3p →4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d →6p → 7s → 5f → 6d → 7p
نکته: به طور کلی هر چه مجموع n وI یک زیرلایه کوچکتر باشد، زیرلایه دارای انرژی کم تری است و زودتر پر می شود.
نکته: اگر مجموع n و I دو زیرلایه یکسان باشد، زیرلایه ای که دارای n کوچکتری است، انرژی کمتری دارد و زودتر پر می شود.
ترتیب پر شدن زیر لایه ها: ( nنشان دهنده شماره دوره است.)
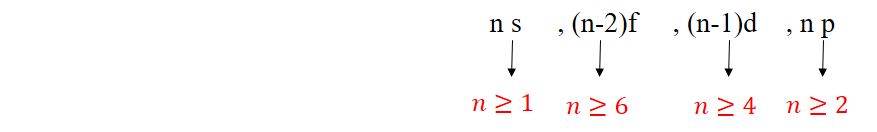
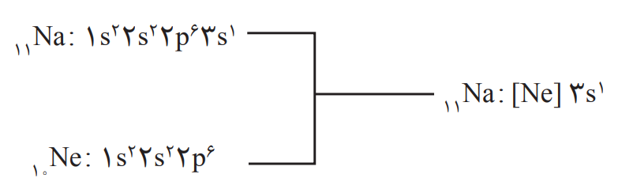
آرایش الكترونی فشرده (شیوۀ دیگر آرایش الکترونی اتم ها):
در این آرایش الكترونی از نماد گاز نجیب استفاده شده است. برای دستیابی به آرایش فشرده، نخست آرایش اتم مورد نظر به صورت گسترده نوشته می شود؛ سپس بخشی از آرایش الكترونی كه همانند آرایش الكترونی یك گاز نجیب است با عبارت ]نماد شیمیایی گاز نجیب[ جایگزین می شود. برای مثال:
تعیین موقعیت عنصرها در جدول دوره ای عناصر
با استفاده از آرایش الکترونی عناصر می توان شماره دوره و گروه عنصر را به ترتیب زیر معین کرد.
آ) بزرگ ترین (n) عدد کوانتومی اصلی در آرایش الکترونی نشان دهنده ی شماره دوره آن است.
ب) برای تعیین شماره گروه عناصر، سه حالت پیش می آید:
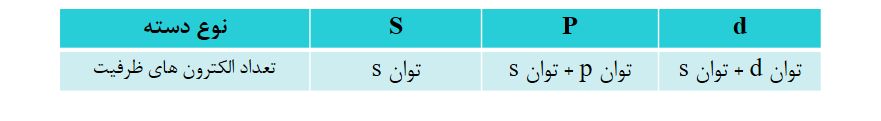
1) اگر عنصر متعلق به دسته (s) باشد، شماره گروه آن برابر با توان (s) است.
2) اگر عنصر متعلق به دسته (p) باشد، شماره گروه آن برابر با (توان 12+p) است.
3) اگر عنصر متعلق به دسته (d) باشد، شماره گروه آن برابر با (توان d + توان s) است.
نکته: با توجه به این که آخرین الکترون وارد شده به اتم، در کدام زیرلایه قرار می گیرد، عناصر در چهار دسته ی S، P، d، f، جای می گیرند و تعداد الکترون های ظرفیت این عناصر (به جز دسته ی f) به صورت زیر است:
نکته: لایه طرفیت، بیرونی ترین لایه ی اتم و لایه ای است که الکترون های آن، رفتار شیمیایی اتم را تعیین می کند.
گازهای نجیب
1. در طبیعت به شكل تك اتمی یافت می شوند.
2. واكنش ناپذیر بوده یا واكنش پذیری بسیار كمی دارند، از این رو پایدارند.
3. در لایه ی ظرفیت این اتم ها، هشت الكترون وجود دارد (به جز هلیم كه در تنها لایه ی الكترونی خود، دو الكترون دارد).
* آرایش الکترون – نقطه ای عناصر هم گروه با هم یکسان است. ( به جز گروه 18 که آرایش الکترون نقطه He با سایر عناصر گروه متفاوت است.
* توجه کنید که در آرایش He، 2 الکترون باید به صورت جفت نمایش داده شوند، نه تکی.
* بیش ترین تعداد الکترون های تکی مربوط به گروه 14 جدول دوره ای هستند.
تبدیل اتم ها به یون ها
برای نوشتن آرایش یون مثبت، بعد از نوشتن آرایش الکترونی اتم، به تعداد بار یون از آخرین زیر لایه (زیر لایه دارای n بزرگتر) الکترون ها را جدا کنید و اگر زیر لایه آخر الکترون کافی نداشت، از زیر لایه ما قبل آخر الکترون جدا کنید.
اگر آرایش الکترونی کاتیونی داده شود و بخواهید آرایش الکترونی اتم خنثی را بنویسید باید به تعداد بار مثبت و به ترتیب پر شدن زیر لایه ها به آرایش کاتیون الکترون اضافه کنید.
برای نوشتن آرایش یون منفی، ابتدا آرایش الکترونی اتم مورد نظر را نوشته و سپس به تعداد بار یون به آخرین زیر لایه موجود الکترون اضافه کنید.
اگر آرایش الکترونی آنیونی داده شود و آرایش الکترونی اتم خنثی را بخواهید، کافی است به تعداد بار آنیون، از آخرین زیر لایه موجود در آنیون الکترون کم کنید.
پیوند یونی: وقتی اتم یک فلز و یک نافلز در کنار هم قرار می گیرند معمولا انتقال الکترون بین آن ها صورت می گیرد.
به طوری که اتم فلز الکترون از دست داده و به کاتیون تبدیل می شود. اتم نافلز الکترون گرفته و به
آنیون تبدیل می شود. نیروی جاذبه ی بسیار قوی برقرار شده در این شرایط که پیوند یونی نامیده می شود.
برای نام گذاری پیوند های یونی ابتدا نام کاتیون و سپس نام آنیون موجود در ترکیب آورده می شود.
تست 1:

تست 2:

تست 3:

تست 4:

دوستان عزیز می توانید برای دسترسی به نسخه کامل خلاصه نکات به همراه پاسخ فایل پی دی اف زیر را دانلود کنید!
فراموش نکنید اگر سوالی در رابطه با این مبحث داشتید می توانید به راحتی در کامنت ها سوال خود را برای ما بنویسید.
دوستان عزیزم؛ برای ارتباط با رتبه برترها صفحه اینستاگرام زیر رو دنبال کنید.
با آرزوی موفقیت و کامیابی


