سلام و خداقوت به بچه های دهم تجربی.
امروز قراره بخشی از فصل اول شیمی دهم تجربی رو باهم یاد بگیریم.
امیررضا حکمت نیا- دانشجوی پزشکی دانشگاه تهران
خب بریم که باهم این مبحث شیمی که از پایه ترین و مهم ترین مباحث شیمی هست رو یاد بگیریم!
نور کلیدی برای شناخت جهان:
- _اتم هیدروژن به عنوان ساده ترین اتم، تنها دارای یک پروتون در هسته و یک الکترون پیرامون آن است که در گسترۀ مرئی طیف نشری خطی بدست آمده از اتم های آن، وجود چهار خط یا نوار رنگی با طول موج و انرژی معین، تایید شده است.

- توجه: هر نوار رنگی در طیف نشری خطی، نوری با طول موج و انرژی معین را نشان میدهد.
- _ نیلز بور بر این باور بود که با بررسی تعداد و جایگاه نوارهای رنگی در طیف نشری خطی هیدروژن، میتوان اطلاعات ارزشمندی از ساختار اتم هیدروژن بدست آورد.
- _ بور پس از پژوهش های بسیار، با در نظر گرفتن این که الکترون در اتم هیدروژن انرژی معینی دارد، توانست مدلی برای اتم هیدروژن ارائه کند..
- خیلی مهم : مدل بور با موفقیت توانست طیف نشری خطی هیدروژن را توجیه کند اما توانایی توجیه طیف نشری خطی دیگر عنصر ها را نداشت.
- بیشتر بدانیم مفید:اگرچه مدل اتمی بور توانایی توجیه طیف نشری خطی سایر عنصرها ( به جز هیدروژن ) را نداشت، ولی گام بسیار مهمی برای بهبود نگرش دانشمندان به ساختار اتم بود و مدل اتمی بور زمینه ساز ارائۀ مدل کامل تری برای اتم به نام مدل کوانتومی گردید.
اینم تصویر آقای نیلز بور ! به پاس همه خدماتش:

مدل کوانتومی:
- _دانشمندان به دنبال توجیه و علت ایجاد طیف نشری خطی عنصرها (به جز هیدروژن !) ونیز چگونگی نشر نور از اتم ها، مدل لایه ای (کوانتومی) برای اتم ارائه کردند.
- _در مدل لایه ای، اتم را کره ای در نظر می گیرند که هسته در فضایی بسیار کوچک و در مرکز آن جای دارد و الکترونها در فضایی بسیار بزرگ تر و در لایههای پیرامون هسته توزیع می شوند.
- خیلی مهم : لایههای الکترونی را از هسته به سمت بیرون شماره گذاری میکنند و شمارۀ هر لایه را با n نمایش می دهند.
- خیلی مهم : n، عدد کوانتومی اصلی نامیده میشود که برای لایه اول 1 = n و برای لایه دوم 2 = n،.... و برای لایه هفتم 7 = n است.
- در ساختار لایهای اتم، هر بخش پر رنگ، مهم ترین بخش از یک لایه الکترونی را نشان میدهد، بخشی که الکترونهای مربوط به هر لایه بیشتر (نه همه !) وقت خود را در فضای مربوط به آن لایه سپری میکنند.
دامهای مورد علاقه طراحان در تستها:
- 1_ الکترون در هرلایهای میتواند در همه نقاط پیرامون هسته حضور یابد اما احتمال حضور آن در محدوده یاد شده (قسمت پر رنگ لایه الکترونی) بیشتر است.
- 2_ مدل بور با موفقیت توانست طیف نشری خطی هیدروژن را توجیه کند اما توانایی توجیه طیف نشری خطی دیگر عنصر ها را نداشت.
- کمیتهای گسسته و پیوسته:
- کمیتها را می توان به دو دسته پیوسته و گسسته (کوانتومی) تقسیم نمود :
- کمیت پیوسته : کمیتهایی که می توانند هر مقداری داشته باشند. مانند طول پارچه، مقدار آب و...
- کمیت گسسته : کمیتهایی که فقط می توانند مقادیر مشخص و مجزایی داشته باشند. مانند تعداد دانشآموزان، تعداد تخم مرغ و....
مثال: خرمن گندم از دور به صورت توده ای یکپارچه است اما دیدن آن از نزدیک دانه های جدا از هم را نشان میدهد.
توجه : انرژی نیز همانند ماده در نگاه ماکروسکوپی، پیوسته اما در نگاه میکروسکوپی به صورت کوانتومی (گسسته) است.- الکترونها در اتم هنگام انتقال بین لایهها به صورت کوانتومی عمل میکنند.
- برای نمونه، هنگامی که به اتمهای گازی یک عنصر با تابش نور یا گرم کردن، انرژی داده میشود، الکترونها با جذب انرژی معین، از لایهای به لایه بالاتر انتقال مییابند.
- نکته مهم : علت نام گذاری این مدل به مدل کوانتومی، گسسته ( کوانتومی ) بودن داد وستد انرژی هنگام انتقال الکترون از یک لایه به لایه دیگر است. در واقع الکترون میان دو لایه، انرژی معین و تعریف شده ای ندارد و هنگام انتقال از یک لایه به لایه دیگر، انرژی را به صورت پیمانه ای یا بسته های معین جذب یا نشر میکنند.
توجه : در یک اتم، هرچه مقدار انرژی جذب شده بیشتر باشد، الکترونها به لایههای بالاتری انتقال می یابند.
- نکته مهم: اکنون می توان گفت هر نوار رنگی در طیف نشری خطی هر عنصر، پرتوهای نشر شده هنگام بازگشت الکترونها از لایههای بالاتر به لایههای پایین تر را نشان میدهد. از آنجا که انرژی لایههای الکترونی پیرامون هسته هر اتم ویژه همان اتم و به عدد اتمی آن وابسته است، انرژی لایهها و تفاوت انرژی میان آن ها در اتم عنصرهای گوناگون متفاوت است؛ بنابراین انتظار می رود هر عنصر طیف نشری خطی منحصر به فردی ایجاد کند.
- چگونگی ایجاد طیف نشری خطی هیدروژن:
نکات شکل 1) نوار بنفش :
دارای کوتاه ترین طول موج (nm410) و بیشترین انرژی بوده و حاصل بازگشت الکترون از 6=n به 2=n است.
2) نوار نیلی :
دارای طول موج nm434 بوده و حاصل بازگشت الکترون از 5=n به 2=n است.
3) نوار آبی روشن :
دارای طول موج nm486 بوده و حاصل بازگشت الکترون از 4=n به 2=n است.
4) نوار قرمز :
دارای بلند ترین طول موج (nm 656) و کمترین انرژی بوده و حاصل بازگشت الکترون از 3= n به 2= n است.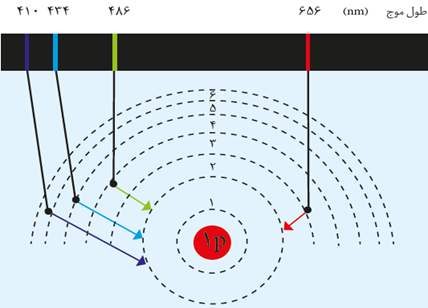
- نکات حیاتی !
1) در اتم عنصر هیدروژن، با افزایش عدد کوانتومی اصلی لایهها و دور شدن از هسته، اختلاف طول موج لایههای متوالی کاهش می یابد.
2) مقایسه طول موج و انرژی پرتوهای نشر شده از انتقال الکترونها بین دو لایه متوالی به صورت زیر است :
- _ انرژی پرتوهای نشر شده با دور شدن از هسته، بین دولایه متوالی کاهش و طول موج، افزایش می یابد.
3) فاصله طول موج های نوار های متوالی در طیف نشری خطی اتم عنصر هیدروژن، با افزایش طول موج (در سمت نوار قرمز) افزایش میابد.
سرخ – آبی (nm 170) > آبی – نیلی (nm 52) > نیلی - بنفش (nm 24) : تفاوت طول موج
4) در زیر انواع پرتوهای نشر شده از انتقالات الکترونی در اتم هیدروژن مورد بررسی قرار گرفته است :- بازگشت الکترون از لایههای بالاتر به لایه اول --> نشر پرتوی فرابنفش
- بازگشت الکترون از لایههای سوم تا ششم به لایه دوم --> نشر پرتوی مرئی
- بازگشت الکترون از لایههای بالاتر به یکی از لایههای سوم تا ششم --> نشر پرتوی فروسرخ
5) نکته : تمامی ایزوتوپ های یک عنصر به دلیل داشتن آرایش الکترونی یکسان، طیف نشری خطی یکسانی دارند.
توزیع الکترون در لایهها و زیرلایهها:
- _عنصر های جدول دوره ای بر مبنای عدد اتمی (Z)(نه عدد جرمی یا A!) یا شمار الکترونهای اتم خود چیده شده اند. به طوریکه اتم H و He به ترتیب با یک و دو الکترون اولین و دومین عنصر جدول هستند.این روند تا عنصر 118 جدول دوره ای ادامه می یابد و اتم هر عنصری نسبت به اتم عنصر پیش از خود یک الکترون بیشتر دارد.
- _از سوی دیگر اتم، ساختار لایه ای دارد و الکترونها در لایههای پیرامون هسته با نظم ویژه ای حضور دارند به گونه ای که در اتم عنصر های ردیف اول، لایه اول الکترونی و در عنصر های ردیف دوم، لایه دوم الکترونی از الکترون پر می شوند. پس :
- عدد کوانتومی اصلی (n):
- _ عددی است که مشخص میکند الکترون مورد نظر در کدام لایه الکترونی قرار دارد.
- _ با دور شدن از هسته، عدد کوانتومی اصلی (n) لایههای الکترونی افزایش می یابد و با افزایش n، سطح انرژی لایههای الکترونی و الکترونهای موجود در آن لایه افزایش می یابد.
- حداکثر تعداد الکترونهای یک لایه الکترونی با عدد کوانتومی اصلی n، برابر با 2n2 می باشد.
2n2= حداکثر گنجایش الکترونی در لایه nام
عدد کوانتومی اصلی (l):
- 1_ هر لایه الکترونی از یک یا چند زیرلایه تشکیل شده است.
- 2_ تعداد زیرلایهها در هر لایه الکترونی برابر عدد کوانتومی اصلی (n) می باشد. برای مثال در لایه سوم (3= n)، سه زیرلایه وجود دارد.
- n : تعداد زیرلایههای لایه n ام
- 3_ برای مشخص کردن نوع زیرلایه از عدد کوانتومی فرعی ( l ) استفاده میشود.
- 4_ مقادیر مجاز برای عدد کوانتومی فرعی، اعداد صحیح صفر تا (1 – n) است.
- 5_ حداکثر گنجایش یک زیرلایه با عدد کوانتومی فرعی l برابر با 2 + l4 می باشد.
- 2 + l4 = حداکثر گنجایش یک زیرلایه
- 6_ هر زیرلایه با نماد nl نمایش داده میشود، پس دقت کنید نماد هر زیرلایه با دو عدد کوانتومی مشخص میشود ! (نه یک عدد کوانتومی !)
- 7_ زیرلایههایی که دارای ضرایب ( n ) یکسانی هستند، یک لایه الکترونی را تشکیل می دهند. برای نمونه، لایه سوم (3=n)، حاوی زیرلایههای s3، p3 و d3 می باشد.
- _ اتم را می توان کره ای در نظر گرفت که هسته بسیار کوچک و سنگینی در مرکز آن جای دارد و مرکز تمرکز پروتون ها و نوترون هاست و پیرامون هسته، الکترونها در لایههای الکترونی قرار دارند.
_هر لایه خود از زیرلایههای متفاوتی تشکیل شده اند به گونه ای که لایه اول دارای یک زیرلایه از نوع s (s1) با گنجایش 2 الکترون، لایه دوم دارای دو زیرلایه از نوع s و p (s2 و p2) با گنجایش 2 و 6 الکترون، لایه سوم دارای سه زیرلایه از نوع s، p و d (s3، p3 و d3) با گنجایش 2، 6 و 10 الکترون است.
- _ اتم را می توان کره ای در نظر گرفت که هسته بسیار کوچک و سنگینی در مرکز آن جای دارد و مرکز تمرکز پروتون ها و نوترون هاست و پیرامون هسته، الکترونها در لایههای الکترونی قرار دارند.
_در یک اتم با دور شدن از هسته، نیروی جاذبه هسته روی الکترون مورد نظر کم میشود. از این رو سطح انرژی الکترونها افزایش یافته و از پایداری الکترونهای موجود در اتم کاسته میشود.
برای دانلود فایل pdf و کامل تر این درسنامه به همراه نکات، به فایل های ضمیمه در پایین مراجعه کن:))


