سلام دوستان عزیز
در این مطلب میخواهیم نکته ها و حفظیات صفحات 76 تا 96 شیمی یازدهم مطابق با بودجه بندی آزمون 5 آذر که برای پاسخگویی به سوالات آزمون باید به آنها مسلط باشید، بپردازیم.
| دانشجوی مهندسی عمران دانشگاه تهران رتبه 328 منطقه دو - کنکور ریاضی 1398 |
بودجه بندی فصل دوم شیمی 2 در کنکور سال های اخیر

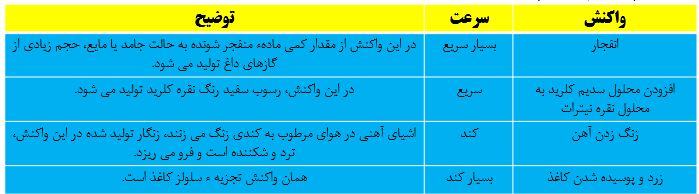
غذای سالم و آهنگ واکنش:
شرایط زیر فساد مواد غذایی را به تاخیر می اندازد و ماندگاری را افزایش می دهد:
محیط سرد، محیط خشک، محیط تاریک و حذف اکسیژن از محیط
آهنگ واکنش:
آهنگ واکنش کمیتی است که نشان می دهد هر تغییر شیمیایی در چه مدت زمانی انجام می شود؛ هرچه مدت زمان انجام یک واکنش کم تر باشد، آهنگ انجام آن تند تر است و واکنش سریع تر انجام می شود.
شیمی دان ها آهنگ انجام واکنش را در گسترهء معینی از زمان به نام سرعت واکنش بیان می کنند. زمان انجام واکنش ها می تواند گستره ای ازچند صدم ثانبه تا چند سده را در بر گیرد.
سرعت واکنش از دیدگاه کمی:
از آنجا که در یک واکنش شیمیایی با گذشت زمان، واکنش دهنده ها مصرف و فرآورده ها تولید می شوند. می توان آهنگ مصرف واکنش دهنده ها و تولید فرآورده ها را در بازه ای از زمان اندازه گیری کرد.
سرعت مصرف یا تولید آن ماده در گستره ی زمانی قابل اندازه گیری(R>0) در واکنش فرضی A→B 
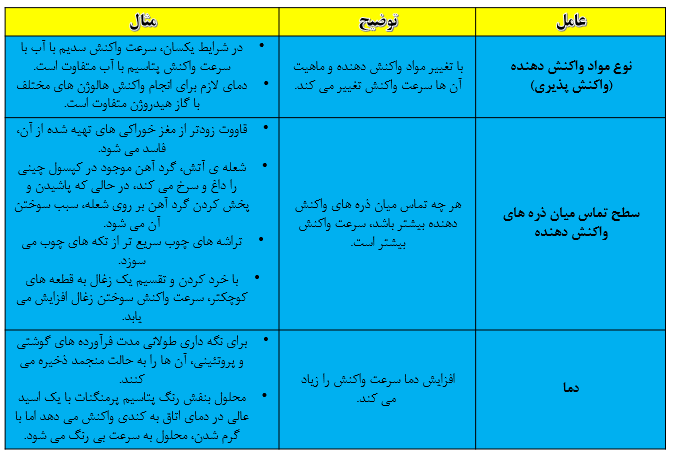
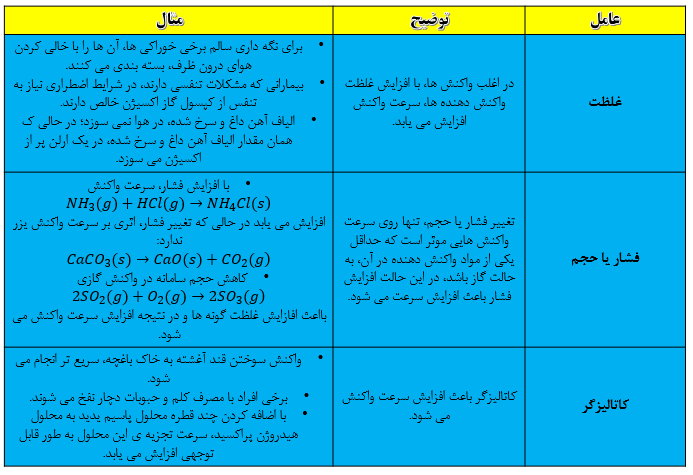
سرعت انجام واکنش به نوع مواد واکنش دهنده، سطح تماس واکنش دهنده ها، غلظت واکنش دهنده ها، دما و کاتالیزگر وابسته است.
نکته: کاتالیزگر ماده ای است که سرعت واکنش شیمیایی را افزایش می دهند ولی خود مصرف نمی شود. مثلا حضور کاتالیزگر KI سبب تسریع تجزیه شدن هیدورژن پراکسید در دمای اتاق می شود.
نکته: هرچه سطح جامدات کوچک تر باشد سرعت انجام واکنش بیش تر است.
نکته: در برخی واکنش های تغییر غلظت تاثیری بر سرعت واکنش ندارد.
نکته: در واکنش هایی که حداقل یکی از واکنش دهنده ها گازی باشد تغییر فشار، سرعت انجام واکنش را تغییر خواهد داد.
نکته: افزایش دما سبب افزایش انرژی ذرات و طبیعتا افزایش سرعت انجام واکنش می شود.
نکته: افزودن کاتالیزگر سبب افزایش مقدار فرآورده نمی شود بلکه همان مقدار فرآورده با سرعت بیش تر و در زمان کوتاه تری تولید می شود.
نکته: نگهدارنده ها سرعت واکنش های شیمیایی را که منجر به فساد می شود، کاهش می دهند. یکی از این مواد بنزوییک اسید است که در توت فرنگی و تمشک موجود است.
سرعت واکنش: اگر سرعت تولید یا مصرف هر یک از مواد شرکت کننده در واکنش را بر ضریب استوکیومتری آن ماده تقسیم کنیم، سرعت متوسط واکنش حاصل می شود.
سرعت متوسط واکنش گازی: aA → bB
از رابطه زیر به دست می آید: 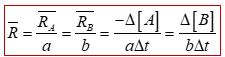
* در یک واکنش، سرعت مصرف واکنش دهنده ها و سرعت تولید فرآورده ها هر دو با گذشت زمان کاهش می یابند؛ زیرا در یک واکنش به تدریج با مصرف واکنش دهنده ها غلظت آن ها کم شده و سرعت واکنش کاهش می یابد. از طرفی سرعت تولید فرآورده ها نیز تابع سرعت مصرف واکنش دهنده ها است؛ بنابراین سرعت تولید فرآورده ها نیز کاهش می یابد.
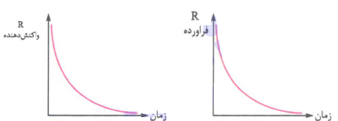
* در یک واکنش، نمودار، «مول یا غلظت – زمان» مربوط به فرآورده ها صعودی و نمودار «مول یا غلظت – زمان» مربوط به واکنش دهنده ها نزولی است.
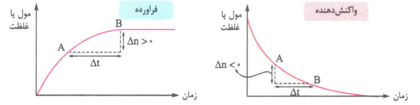
در مورد فرآورده ها، شیب نمودار، سرعت متوسط تولید فرآورده را نشان می دهد؛ اما در مورد واکنش دهنده ها از آنجا که شیب نمودار، عددی منفی است، قدر مطلق شیب، سرعت متوسط مصرف واکنش دهنده ها را نشان می دهد.
* در لحظهء پایان واکنش، نمودار «مول یا غلظت – زمان» فرآورده به صورت خط راست و افقی در می آید؛ یعنی شیب این نمودار و سرعت واکنش به صفر می رسد.
توجه: فرم کلی مقدار – زمان واکنش دهنده ها و فرآورده های جامد و مایع خالص، مانند شکل های قبل است، اما گفتیم که غلظت مواد جامد و مایع خالص همواره مقدار ثابتی می باشد؛ بنابراین نمودار غلظت – زمان برای این مواد به صورت رو به رو خواهد بود:
آشنایی اولیه با کربوکسیلیک اسیدها
کربوکسیلیک اسیدها دسته ای از ترکیب های آلی هستند که در ساختار آن ها یک یا چند گروه عاملی کربوکسیل وجود دارد.
1- آشناترین عضو خانوادهء کربوکسیلیک اسیدها، اتانوییک اسید (استیک اسید) با فرمول (C2H4O2)CH3COOH است.
2- از بنزوئیک اسید که یک عضو خانوادهء کربوکسیلیک اسیدها است، در صنایع غذایی به عنوان نگهدارنده استفاده می شود. نگهدارنده ها، سرعت واکنش واکنش شیمیایی را که منجر به فساد مواد غذایی می شوند، کاهش می دهند.
فرمول مولکولی بنزوئیک اسید C7H6O2 بوده و از ساختار آن به صورت رو به رو است: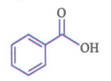
* در ساختار بنزوئیک اسید، یک حلقهء بنزنی وجود دارد؛ بنابراین این ترکیب، آروماتیک محسوب می شود.
* بنزوئیک اسید در تمشک و توت فرنگی وجود دارد.
* توجه: بنزآلدهید که در بادام وجود دارد، دارای فرمول مولکولی C7H6O است، یعنی یه اتم اکسیژن از بنزوئیک اسید کمتر داره.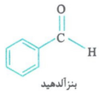
تست 1:
mL 750 هیدروکلریک اسید 0.1 مولار را با مقدار اضافی کلسیم کربنات واکنش می دهیم. اگر سرعت متوسط کاهش جرم مخلوط در 30 ثانیه اول و دوم به ترتیب 1.32 و 0.88 گرم بر دقیقه باشد، به ترتیب از راست به چپ سرعت متوسط خروج گاز در این بازه 60 ثانیه ای چند مول بر دقیقه است و چند گرم کلسیم کربنات در واکنش مصرف شده است؟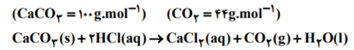
1) 0.05 و 50 2) 0.25 و 25 3) 0.05 و 5 4) 0.025 و 2.5
تست 2:
در ظرفی به حجم 5 لیتر، 1023 × 3.01 مولکول آمونیاک را در شرایط مناسب قرار می دهیم تا به گازهای هیدروژن و نیتروژن تجزیه شود. اگر پس از 80 ثانیه از شروع واکنش، مجموع شمار مولکول های درون ظرف برابر 1023 × 4.0214 باشد، سرعت تولید گاز هیدروژن بر حسب mol.L-1.min-1 کدام است؟
1) 0.15 2) 0.045 3) 0.015 4) 0.45
تست 3:
در یک ظرف شیشه ای دارای mL 100 محلول mol.L-1 0.06 هیدروکلریک اسید که دهانهء آن به یک سرنگ استوانه ای به قطر cm2 متصل است، یک تکه نوار منیزیم با جرم معین انداخته می شود. برای انجام نیمی از این واکنش، به چند ثانیه زمان نیاز است و در این هنگام، پیستون چند cm نسبت به محل اولیهء خود جابه جا می شود؟ (حجم مولی گاز در شرایط آزمایش برابر L20 و π = 3 فرض شود، Mg=24g.mol-1)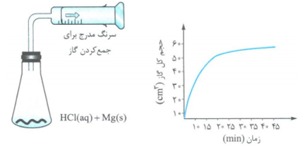
1) 600، 100 2) 600، 20 3) 60، 20 4) 60، 10
دوستان عزیز می توانید برای دسترسی به نسخه کامل خلاصه نکات به همراه پاسخ فایل، پی دی اف زیر را دانلود کنید!
فراموش نکنید اگر سوالی در رابطه با این مبحث داشتید می توانید به راحتی در کامنت ها سوال خود را برای ما بنویسید.
برای ارتباط با رتبه برترها صفحه اینستاگرام زیر رو دنبال کنید.
با آرزوی موفقیت و کامیابی



