سلام
در این مطلب میخواهیم با هم به جمع بندی نکات فصل دو شیمی دهم (مطابق با آزمون جامع) و خلاصه نکات که برای پاسخگویی به سوالات آزمون باید به آنها مسلط باشید، بپردازیم.
نوید آرمات، دانشجوی مهندسی عمران دانشگاه تهران
سیده محدثه حسینی، دانشجوی دکتری تخصصی پیوسته بیوتکنولوژی دانشگاه تهران
کاربرد های گاز نیتروژن
1- بسته بندی برخی مواد خوراکی 2- پرکردن تایر خودرو 3- صنعت سرماسازی برای انجماد مواد غذایی
4- نگه داری نمونه های بیولوژیک که در پزشکی استفاده می شود.
فرآیند تقطیر جزء به جزء هوای مایع
1- هوا را از صافی عبور می دهند تا گرد و غبار آن گرفته شود.
2- با استفاده از تغییر فشار زیاد، دمای هوا را تا دمای نزدیک به (200°C –) کاهش می دهند.
3- با کاهش دمای هوا تا (0 درجه سانتی گراد ) ابتدا رطوبت موجود در هوا به صورت یخ از آن جدا می شود. سپس در دمای (78- درجه سانتی گراد)
گاز CO2 به حالت جامد درآمده و از مخلوط سایر گازها جدا می شود. سایر گازها در دمای (200– درجه سانتی گراد) به صورت مایع در می آیند و سپس با توجه به نقطه جوششان از مخلوط جدا می شوند.
کاربرد های هلیم
1- پر کردن بالن های هواشناسی، تفریحی و تبلیغاتی
2-جوشکاری
3- کپسول غواصی
4- برای خنک کردن قطعات الکترونیکی در دستگاه های تصویربرداری مانندMRI استفاده می شود.
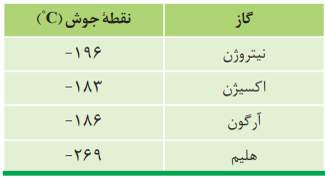
مقدار گازهای نجیب هلیم، نئون، آرگون، کریپتون، زنون و رادون در هواکره بسیار کم است. از این رو به گازهای کم یاب معروف هستند.
توجه: برخی از کاربردها و ویژگی های هلیم به صورت زیر است:
1- به عنوان سبک ترین گاز نجیب، بی رنگ، بی بو و بی مزه است.
2- در کره ی زمین به مقدار خیلی کم یافت می شود، به طوری که مقدار ناچیزی از آن در هوا و مقدار بیشتری در لایه های زیرین پوسته زمین وجود دارد. به همین دلیل منابع زمینی آن از هواکره سرشارتر و برای تولید هلیم در مقیاس صنعتی مناسب ترند.
3- هلیم از واکنش های هسته ای در اعماق زمین تولید می شوند. این گاز پس از نفوذ به لایه های زمین وارد میدان های گازی می شوند.
4- بر اساس یافته های تجربی حدود 7 درصد حجمی مخلوط گاز طبیعی را هلیم تشکیل می دهد. البته مقدار هلیم در میدان های گازی گوناگون متفاوت است.
5- هلیم را می توان از تقطیر جز به جز گاز طبیعی به دست آورد که تهیه ی آن از این روش نسبت به تقطیر جز به جز هوای مایع مقرون به صرفه تر است. هر چند در کشور ما این تکنولوژی وجود ندارد و گاز هلیم وارد می شود.
6- هلیم موجود در گاز طبیعی به همراه سایر فرآورده های سوختی بدون مصرف وارد هواکره می شوند.
توجه: برخی از ویژگی ها و کاربردهای آرگون به صورت زیر است:
1- گاز نجیب، بی رنگ، بی بو و غیر سمی که در بین گازهای تشکیل دهنده هوای پاک خشک رتبه ی سوم را پس از نیتروژن و اکسیژن (از لحاظ درصد حجمی) از آن خود کرده است. برای تهیه ی آن از تقطیر جز به جز هوای مایع استفاده می شود. که با خلوص بسیار زیاد تولید می شود.
2- این واژه (آرگون) به معنای تنبل است، زیرا واکنش پذیری آن بسیار ناچیز بوده و در واقع واکنش ناپذیر است به همین دلیل در لامپ های رشته ای به کار می رود.
3- از این گاز برای ایجاد محیط بی اثر در هنگام جوشکاری و برش فلزات استفاده می شود تا از ترکیب شدن فلزات با اکسیژن هوا در دمای بالای جوشکاری جلوگیری شود و استحکام و طول عمر فلزات افزایش یابد.
4- به دلیل رسانایی گرمایی کم، از آن در فضای میان پنجره های چند جداره استفاده می شود.
اکسیژن
اکسیژن یکی از مهم ترین گازهای تشکیل دهنده هواکره است که دارای ویژگی های زیر است.
1- در هواکره بیشتر به صورت مولکول های دو اتمی (O_2)، در آب کره در ساختار مولکول های آب (H2O) و در سنگ کره به صورت ترکیب با دیگر عنصرها وجود دارد.
2- پس از گاز نیتروژن، فراوان ترین گاز موجود در هواکره است.
3- در ساختار همه ی مولکول های زیستی مانند کربوهیدرات ها، چربی ها و پروتئین ها یافت می شود.
4- هرچه ارتفاع از سطح زمین بیشتر می شود، هواکره رقیق تر شده و غلظت آن کاهش می یابد، بنابراین می توان نتیجه گرفت که با افزایش ارتفاع، غلظت و فشار گاز های هواکره از جمله اکسیژن کمتر می شود. (البته درصد حجمی گازها تغییری نمی کند.)
توجه: به دلیل کمتر بودن فشار گاز اکسیژن در ارتفاع زیاد، کوهنوردان به هنگام صعود به قله های بلند برای آنکه دچار کمبود اکسیژن نشوند از کپسول اکسیژن استفاده میکنند. در ضمن هواپیماها نیز با خود اتاقکی از گاز اکسیژن حمل می کنند تا در مواقع نیاز کمبود اکسیژن احساس نشود.
نمایش واکنش های شیمیایی
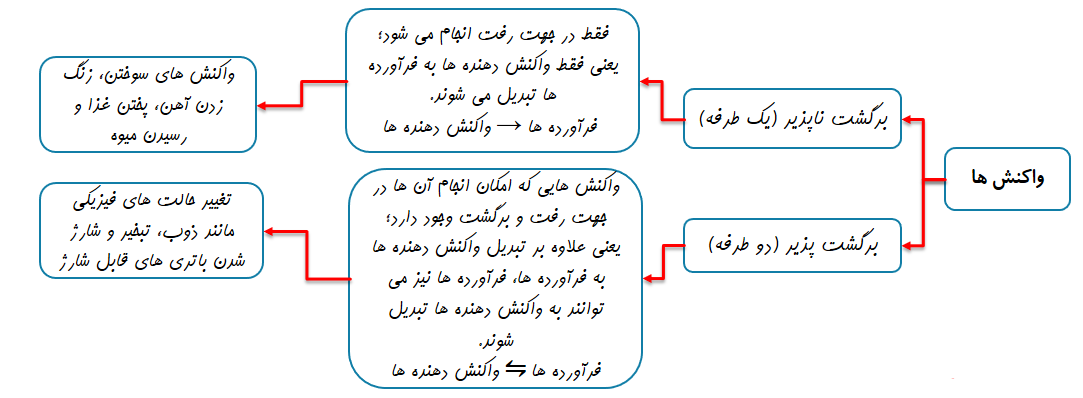
تغییر شیمیایی تغییری است که با تغییر در ساختار و ماهیت مواد همراه است و ماده یا مواد جدیدی تولید می کند این نوع تغییر با تغییر رنگ، مزه، بو و آزاد سازی گاز، رسوب و گاهی ایجاد نور و صدا همراه است. به عنوان مثال گرما دادن به شکر سبب تغییر رنگ آن می شود. سوختن، فساد مواد غذایی و... نمونه هایی دیگر از تغییرات شیمیایی هستند.
موازنه کردن معادله ی واکنش های شیمیایی
بر طبق قانون پایستگی جرم، جرم واکنش دهنده ها با جرم فرآورده ها برابر است. یا به عبارت دیگر جرم کل مواد در طول واکنش ثابت است.
در واکنش های شیمیایی نه اتمی به وجود می آید و نه اتمی از بین می رود، بلکه پس از انجام واکنش، اتم های موجود در واکنش دهنده ها به یون های دیگری به هم متصل می شوند و فرآورده ها را به وجود می آورند.
همانطور که مشاهده می شود معادله زیر موازنه نیست. برای نمونه تعداد تمامی اتم های کربن در سمت راست برابر 1 ولی در سمت چپ برابر 7 است. در حقیقت تعداد اتم های فرآورده ها و واکنش دهنده ها برابر نیست.
C7H16(l)+O2(g)→CO2(g)+H2O(g)
برای موازنه کردن یک معادله شیمیایی می توانید مطابق با گام های زیر پیش بروید.
1- در ابتدا پیچیده ترین ماده را شناسایی کنید.
2- برای ماده انتخاب شده، عنصری را انتخاب کنید که تنها در واکنش دهنده ها یا فرآورده ها ظاهر شده باشد. عنصر انتخاب شده را در طرفین معادله موازنه کنید.
3- در مرحله بعد بارهای یون ها را در طرفین موازنه کنید.
4- اتم های باقی مانده را موازنه کنید. معمولا این فرآیند با ساده ترین ترکیب به پایان می رسد. اگر حتی یکی از ضرایب بدست آمده نیز به صورت کسری هستند می توانید طرفین معادله را در مخرج کسر ضرب کنید؛ با انجام این کار تمامی ضرایب صحیح شده و درک بهتری را از کل معادله بدست خواهید آورد.
5- در گام اخر باید تعداد کل اتم ها را در دو طرف معادله موازنه کنید. در حقیقت تعداد اتم های تمامی عناصر باید در دو سمت معادله برابر باشد.
C7H16(l)+11O2(g)→7CO2(g)+8H2O(g)
ترکیب اکسیژن با فلزها و نافلزها
اغلب فلزها در طبیعت به شکل ترکیب (عمدتا به شکل اکسید) وجود دارند. به طور مثال فلزهای آلومینیم و آهن به ترتیب به صورت ترکیب های بوکسیت (Al2O3 به همراه ناخالصی) و هماتیت (Fe2O3 به همراه ناخالصی) در طبیعت یافت می شوند.
به واکنش آرام مواد با اکسیژن که با تولید انرژی همراه است، اکسایش می گویند. به طور مثال زنگ زدن آهن نمونه ای از واکنش های اکسایش است که در آن آهن با اکسیژن در هوای مرطوب واکنش میدهد.
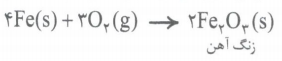
زنگ آهن، متخلخل است و باعث می شود بخار آب و اکسیژن به لایه های زیرین فلز آهن هم نفوذ کند و فرایند اکسایش آهن تا تبدیل همه فلز به زنگار، ادامه پیدا کند. این ماده استحکام لازم را ندارد و در اثر ضربه خرد می شود و فرو می ریزد. به ترد و خرد شدن و فروریختن فلزها بر اثر اکسایش، خوردگی گفته میشود. و اگه دقت کرده باشین! واکنش فلز آهن با اکسیژن می تواند از نوع سوختن یا از نوع اکسایش باشد! بیایید به نیم نگاهی به تفاوت ها و شباهت های این دو واکنش بندازیم!
رفتار فلزها
رفتار همه فلزها در برابر اکسیژن یکسان نیست. به طور مثال با این که فلز آلومینیم نیز با اکسیژن هوا واکنش می دهد و به آلومینیم اکسید تبدیل می شود، اما در برابر خوردگی مقاوم است و برخلاف آهن، لایه های درونی فلز اکسایش نمی یابد؛ به همین دلیل بیشتر وقتا! در ساختمان سازی به جای در و پنجره های آهنی از در و پنجره های آلومینیمی استفاده می شود. حالا دلیل این اتفاق اینه که هر چند آلومینیم واکنش پذیری بیشتری از آهن دارد و خیلی سریع اکسید می شود، اما آلومینیم اکسید تولیدشده ساختاری متراکم و پایدار دارد که محکم به سطح فلز می چسبد و از نفوذ اکسیژن به لایه های زیرین آلومینیم جلوگیری می کند. این طوری میشه که آلومینیم خورده نمی شود.
Al > Zn > Fe :واکنش پذیری
رسم ساختار لوویس
برای رسم انواع ساختار لوویس از الگوریتم داده شده استفاده میکنیم مراحل باید به ترتیب طی شوند.
1- مجموع تعداد الکترون های ظرفیت اتم های موجود در مولکول را محاسبه کنید.
2- تعداد الکترون های لازم برای هشتایی شدن را به صورت زیر محاسبه کنید.

3-

4- اتمی که در فرمول شیمیایی ترکیب مورد نظر در سمت چپ نوشته می شود را (به جز اتم H) به عنوان اتم مرکزی انتخاب کنید.
5- اتم های اطراف را با استفاده از تعداد پیوند های به دست آمده در مرحله ی سوم به اتم مرکزی متصل کنید.
نکته: اتم های هیدروژن و هالوژن ها با پیوند یگانه به اتم مرکزی وصل می شوند.
نکته: اتم های اکسیژن و گوگرد می توانند در صورت نیاز با پیوند دوگانه به اتم مرکزی متصل شوند.
نکته: اتم نیتروژن می تواند با پیوند سه گانه به اتم مرکزی متصل شود.
6- در اطراف (به جز اتم H) به تعداد مورد نیاز برای هشتایی شدن، الکترون ناپیوندی قرار دهید.
برای بدست آوردن بار یون ها، در صورتی که تعداد ساختار لوویس آن داده شده باشد، می توانید از رابطه مقابل استفاده کنید:
تست :
سوخت سبز، سوختی است كه در ساختار خود افزون بر كربن و هیدروژن، اكسیژن نیز دارد و از پسماندهای گیاهی مانند شاخ و برگ گیاه سویا، نیشكر و دانه های روغنی به دست می آید. این مواد زیست تخریب پذیرند، از این رو به وسیله ی جانداران ذره بینی به مواد ساده تر تجزیه می شوند. اتانول و روغن های گیاهی نمونه هایی از این نوع سوخت ها هستند.
شیمی سبز:
1- تولید سوخت سبز 2- تبدیلCO2 به مواد معدنی
3- تولید پلاستیک های سبز 4- دفن کردن کربن دی اکسید
5- تولید خودرو و سوخت با کیفیت بسیار خوب

تروپوسفری
اوزون علاوه بر لایه ی استراتوسفر، در لایه ی تروپوسفر نیز یافت می شود. این گاز در لایه ی تروپوسفر آلاینده ای سمی و خطرناک است؛ به طوری که وجود آن در هوایی که تنفس می کنیم، سبب سوزش چشمان و آسیب دیدن ریه ها می شود.
اوزون تروپوسفری از واکنش گاز قهوه ای رنگ نیتروژن دی اکسید با گاز اکسیژن حضور نور خورشید تولید می شود.

گاز نیتروژن
1- گاز نیتروژن به عنوان اصلی ترین جز سازنده ی هواکره، واکنش پذیری بسیار کمی دارد و به طور معمول با اکسیژن واکنش نمی دهد؛ اما بر اثر رعدوبرق و بالا رفتن دما، با اکسیژن هوا واکنش داده و طی دو مرحله به NO2 تبدیل می شود.

2- در هوای آلوده ی شهرهای صنعتی و بزرگ، مقدار زیادی اکسیدهای نیتروژن وجود دارد. در واقع این گازها، از واکنش گازهای نیتروژن و اکسیژن درون موتور خودرو در دمای بالا به وجود می آیند.
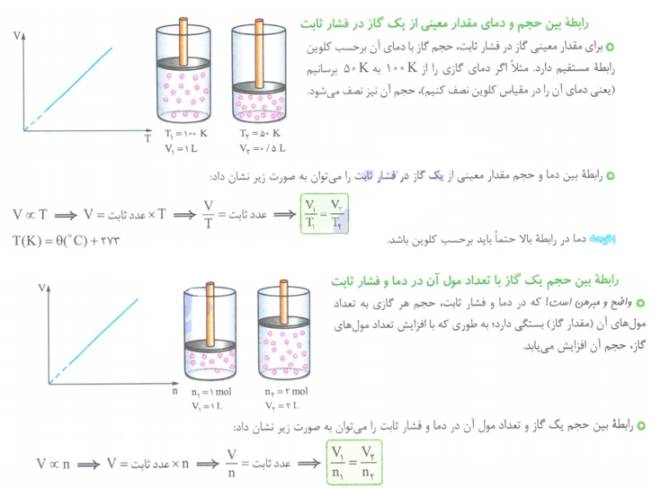
خواص و رفتار گازها:
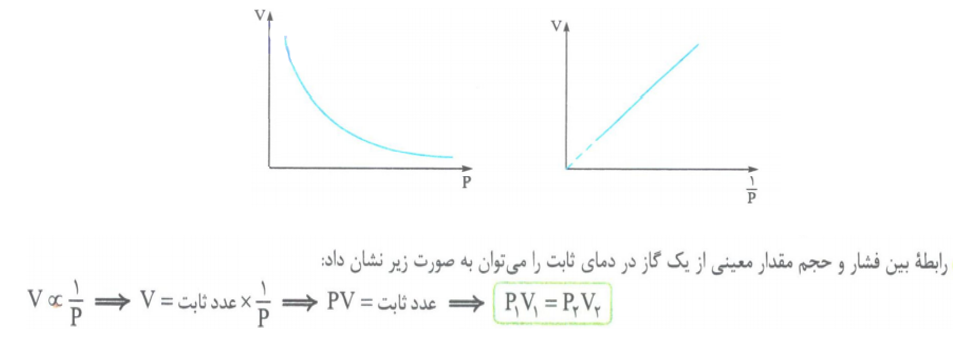
1- رابطه بین فشار و حجم گاز:
به طور کلی برای مقدار مشخصی گاز در دمای ثابت، حجم گاز با فشار آن رابطه عکس دارد. (قانون بویل)
به عنوان مثال اگر فشار وارده بر یک گاز دو برابر شود، حجم آن نصف شده و اگر فشار وارده سه برابر شود، حجم آن 1/3 حجم اولیه خواهد شد.

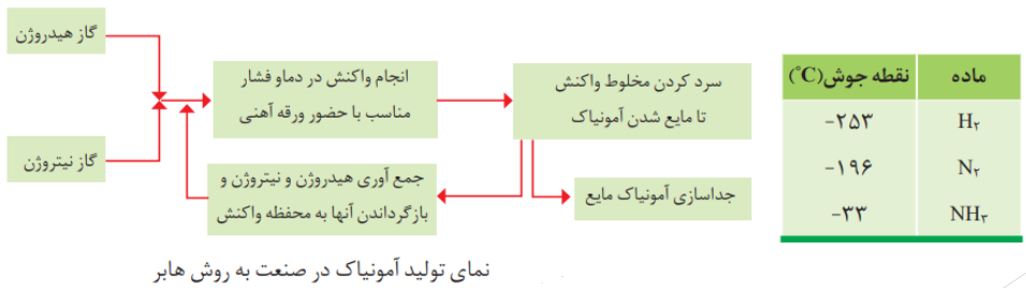
فرآیند هابر
هابر واكنش میان گازهای هیدروژن و نیتروژن را بارها در دماها و فشارهای گوناگون انجام داد تا بتواند شرایط بهینه آن را پیدا كند. سرانجام دریافت که اگر مخلوط این گازها از روی یك ورقه ی آهنی (کاتالیزگر) در دما و فشار مناسب عبور داده شود با انجام واكنش، مقدار قابل توجهی آمونیاك تولید می شود؛ اما همه ی واكنش دهنده ها به فرآورده تبدیل نخواهد شد؛ زیرا این واكنش برگشت پذیر است؛ با این توصیف در ظرف واكنش مخلوطی از سه گاز هیدروژن، نیتروژن و آمونیاك وجود دارد.
تست :

تست :

دوستان عزیز می توانید برای دسترسی به نسخه کامل خلاصه نکات به همراه پاسخ فایل پی دی اف زیر را دانلود کنید!
فراموش نکنید اگر سوالی در رابطه با این مبحث داشتید می توانید به راحتی در کامنت ها سوال خود را برای ما بنویسید.
دوستان عزیزم؛ برای ارتباط با رتبه برترها صفحه اینستاگرام زیر رو دنبال کنید.
با آرزوی موفقیت و کامیابی


