سلام دوستان عزیز
در این مطلب می خواهیم به خلاصه نکات و حفظیات فصل اول شیمی دوازدهم مطابق با بودجه بندی آزمون 24 دی که برای پاسخگویی به سوالات آزمون باید به آنها مسلط باشید، بپردازیم.
 | دانشجوی مهندسی عمران دانشگاه تهران رتبه 328 منطقه دو - کنکور ریاضی 1398 |
برای ارتباط بیشتر با برترها و رزرو پشتیبان ویژه، را دنبال کنید، همچنین میتونید با شماره ۰۲۱۸۴۵۱ داخلی ۳۱۲۳ تماس بگیرید.
بودجه بندی فصل اول شیمی 3 در کنکور سال های اخیر
همه چیز درباره صابون ها
اسید های چرب، کربوکسیلیک اسید هایی با زنجیر بلند کربنی هستند مانند: CH3(CH2)16COOH چربی ها مخلوطی از اسید های چرب و استر های بلند زنجیر( با جرم مولی زیاد) است.
به نمک اسیدهای چرب، صابون می گویند. صابون های چامد، نمک سدیم اسید چرب و صابون های مایع، نمک پتاسیم یا آمونیم اسید چرب هستند.
جز آنیونی خودش دو بخش دارد:
1- بخش زنجیر هیدروکربنی که اب گریز است و در نتیچه چربی دوست است و سر ناقطبی صابون را تشکیل می دهد.
2- بخش -COO که سر قطبی و آب دوست آن است.
صابون به کمک سر آب دوست خود در آب حل می شود. از طرفی ذره های صابون با بخش چربی دوست خود (بخش ناقطبی جزء آنیونی) با مولکول های چربی جاذبه برقرار می کنند. انگاری مولکول های صابون مانند پلی بین مولکول های آب و چربی قرار می گیرند؛ به این ترتیب صابون می تواند مخلوط پایداری از چربی ها را در آب ایجاد کند.
کلویید ها
کلوئیدها و سوسپانسیو نها جزء مخلوطهای ناهمگن هستند. ذره های سازنده این مخلوط ها، درشت تر از محلول ها است، به همین دلیل برخلاف محلولها نور را پخش می کنند.
کلوئید برخلاف محلول، مسیر عبور نور از میان کلوئیدها قابل دیدن است. ذره های سازنده کلوئیدها همانند محلول ها با گذشت زمان ته نشین نمی شوند؛ بنابراین می توان گفت کلوئیدها پایدار هستند. موادی مانند انواع رنگ ها و چسب ها، سرامیک ها، شیر، ژله و سس مایونز کلوئید هستند. اما سوسپانسیون ها (مانند شربت معده) ناپایدارند و با گذشت زمان، ذره های سازنده آنها ته نشین می شوند.
تست 1:

تست 2:

پاک کننده های غیر صابونی:
با افزایش تقاضاهای جهانی برای صابون و کاهش عرضه ی این فرآورده، شیمی دان ها با استفاده از موادی مانند بنزن و دیگر مواد اولیه ی صنایع پتروشیمیایی، موفق شدند پاک کننده های غیر صابونی را تولید کنند.
پاک کننده های خوردنده
بعضی از آلودگی ها مانند رسوب تشکیل شده بر روی دیواره کتری، لوله ها، آبراه ها و دیگ های بخار جوری به سطح می چسبند که با صابون و پاک کننده های غیرصابونی پاک نمی شود. برای رهایی از این نوع آلودگی ها به پاک کننده هایی نیاز است که بتوانند با آنها واکنش شیمیایی داده و آنها را به فرآورده هایی تبدیل کنند که با آب شسته شوند. به این پاک کننده ها، پاک کننده های خورنده می گویند. موادی مانند هیدروکلریک اسید (جوهر نمک)، سدیم هیدروکسید و سفید کننده ها از جمله این پاک کننده ها هستند. این پاک کننده ها از نظر شیمیایی فعال هستند و خاصیت خورندگی دارند به همین دلیل نباید با پوست تماس داشته باشند.
تست 3:

اسید و بازهای آرنیوس:
اسید ها | بازها |
محلول آبی آن ها ترش مزه هستند. | محلول آبی آن ها تلخ مزه هستند. |
کاغذ PH در محلول اسیدی به رنگ سرخ در می آید. | کاغذ PH در محلول بازی به رنگ آبی در می آید. |
بازها را خنثی می کنند. | اسید ها را خنثی می کنند. |
اسید آرنیوس: ماده ای است که در آب حل می شود و یون هیدروزن +H یا پروتون پدید می آورد.
باز آرنیوس: ماده ای است که در آب حل می شود و یون هیدروکسید -OH پدید می آورد.
هر چه غلظت یون هیدرونیوم +H در محلولی بیشتر باشد، آن محلول اسیدی تر و هر چه غلظت یون هیدرکسید -OH در محلولی بیشتر باشد، آن محلول بازی تر است. هم چنین اگر در یک سامانه غلظت یون هیدرونیوم و هیدروکسید با هم برابر باشد، آن سامانه حالت خنثی دارد.
یونش: به فرآیندی که در آن یک ترکیب مولکولی در آب به یون های مثبت و منفی تبدیل می شود، یونش می گویند.
تعادل:
اگه یادتون باشه ! گفتیم که در محلول اسیدهای ضعیف، یون های آبپوشیده به طور همزمان با مولکول های اسید یونیده نشده حضور دارند؛ به طوری که در شرایط معین، غلظت همه گونه های موجود در محلول، ثابت است. حضور همزمان یون ها و مولکول های یونیده نشده با غلظت ثابت در محلول نشان میدهد که محلول اسیدهای ضعیف در آب یک سامانه تعادلی است. حالا ببینیم تعادل یعنی چی؟! در شیمی دهم خواندیم که به واکنش هایی که می توانند در هر دو جهت رفت (تبدیل واکنش دهنده ها به فراورده ها) و برگشت (تبدیل فراورده ها به واکنش دهنده ها) انجام شوند، واکنش های برگشت پذیر می گویند. اگر این واکنش ها در شرایط مناسبی انجام شوند، سرانجام لحظه ای فرا می رسد که سرعت واکنش رفت با سرعت واکنش برگشت برابر می شود. در این لحظه، غلظت واکنش دهنده ها و فراورده ها ثابت می ماند؛ به طوری که همان مقدار از واکنش دهنده ها که در واحد زمان طی واکنش رفت مصرف می شوند، در اثر واکنش برگشت، دوباره تولید می شوند. به همین ترتیب همان مقدار از فراورده ها که در یک واحد زمان طی واکنش رفت تولید می شوند، در اثر واکنش برگشت مصرف می شوند. در این حالت می گوییم واکنش به تعادل رسیده است. برای واکنش های تعادلی از نماد ⇋ استفاده می شود.
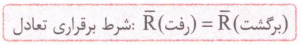
1- هر دو واکنش رفت و برگشت در هنگام تعادل با سرعت برابر انجام می شوند؛ یعنی همواره تبدیل مواد به یکدیگر در حال انجام شدن است. حواستون باشه که در هنگام تعادل، مقدار یا غلظت واکنش دهنده ها و فراورده ها لزوما با هم برابر نیست و فقط می توان گفت که غلظت مواد ثابت می ماند.
۲- همه واکنش های تعادلی، برگشت پذیرند، اما هر واکنش برگشت پذیری، تعادلی نیست. برای برقراری تعادل، سامانه نباید با محیط، مبادله ماده داشته باشد.
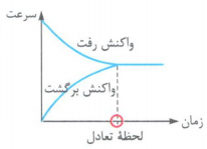
3- اگر فرض کنیم که در ابتدا، فقط واکنش دهنده ها در ظرف واکنش وجود داشته باشند، نمودار «سرعت - زمان» یک واکنش تعادلی را می توان به صورت روبه رو نشان داد:
واکنش برگشت ناپذیر: به واکنشی گفته میشود که واکنش دهنده ها به فرآورده ها تبدیل شوند. اما فرآورده ها نمیتوانند به واکنش دهنده ها تبدیل شوند. مانند سوختن مواد آلی یا واکنش فلز های قلیایی با آب.
نکته: همه ی واکنش های گرماده که شمار مول های گازی فرآورده بیشتر از شمار مول های واکنش دهنده باشد، برگشت ناپذیر هستند.
نکته: در یک واکنش شیمایی اگرq (گرما) در طرفی باشد که تعداد مول های گازی کمتر است، واکنش برگشت پذیر می باشد.
نکته: واکنش های رفت و برگشت در سامانه های تعادلی به طور پیوسته و با سرعت برابر انجام می شوند و به همین دلیل مقدار مواد در واکنش ثابت می ماند.
نکته: تا قبل از برقراری تعادل در یک واکنش برگشت پذیر، خواصی مانند غلظت، جرم، حجم، فشار و رنگ تغییر می کند، اما زمانی که تعادل برقرار شد، غلظت و سایر خواص ثابت می مانند و تغییر نمی کنند. در هنگام تعادل سرعت تولید هر ماده با سرعت مصرف آن ماده برابر است.
نکته: مقدار تغییر غلظت هر ماده بستگی به ضریب استوکیومتری آن ماده در معادله ی موازنه شده ی واکنش دارد. در ضمن غلظت واکنش دهنده ها در واکنش های تعادلی به صفر نمی رسد.
ثابت تعادل:
نکته: تنها عامل موثر بر ثابت تعادل فقط دماست و با تغییر غلظت، تغییر فشار، تغییر حجم ظرف واکنش و یا به کار بردن کاتالیزگر، مقدار ثابت تعادل(K) تغییر نمی کند.
* مقدارK برای یک واکنش تعادلی در دمای معین، مقدار ثابتی است.
* مقدار K در دمای ثابت به مقدار اولیه ی واکنش دهنده ها و فرآورده ها بستگی ندارد.
ثابت یونش اسیدی(Ka) معیاری از قدرت اسید ها
یونیده شدن اسید در آب به صورت برگشت پذیر انجام می شود. هر چه قوی تر باشد، بیشتر یونیده می شود و در هنگام تعادل غلظت +H در محلول آن بیشتر است. بازها نیز مانند اسیدها ثابت یونش دارند که آن را با Kb نمایش می دهند.
* به طور کلی در دما و غلظت یکسان هر چه Kb بازی بزرگتر باشد، آن باز قوی تر است.
تست 4:

دوستان عزیز می توانید برای دسترسی به نسخه کامل خلاصه نکات به همراه پاسخ فایل، پی دی اف زیر را دانلود کنید!
فراموش نکنید اگر سوالی در رابطه با این مبحث داشتید می توانید به راحتی در کامنت ها سوال خود را برای ما بنویسید.
برای ارتباط با رتبه برترها صفحه اینستاگرام زیر رو دنبال کنید.
با آرزوی موفقیت و کامیابی



