سلام
در این مطلب میخواهیم با هم به جمع بندی فصل چهارم شیمی دوازدهم و هم چنین خلاصه نکاتی که برای پاسخگویی به سوالات آزمون باید به آنها مسلط باشید، بپردازیم.
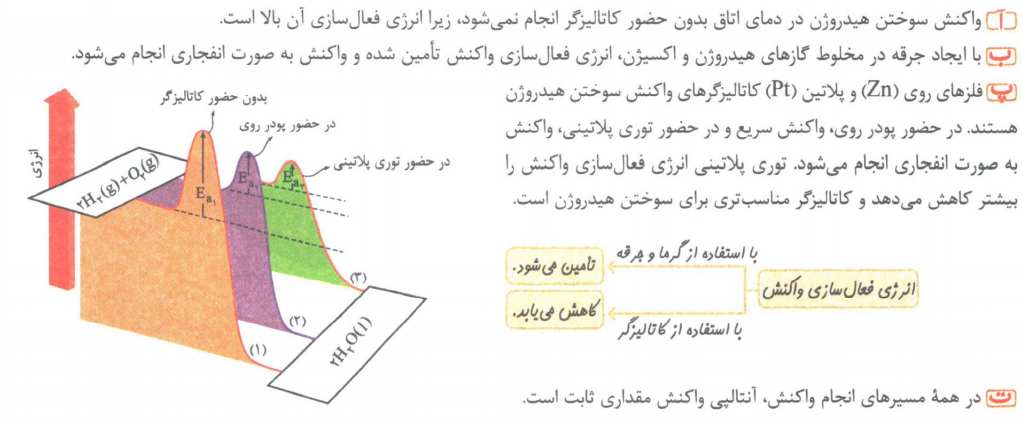
در واکنش های شیمیایی، به مقدار معینی از انرژی برای شروع واکنش نیاز است. به عبارتی دیگر، صرف نظر از اینکه گرماده یا گرماگیر باشند، برای شروع به حداقلی از انرژی نیاز دارندکه آن را با Ea نمایش می دهند و یکای آن کیلو ژول است.
نکته: هرچه انرژی فعالسازی واکنش های شیمیایی کم تر باشد، سرعت انجام واکنش های شیمیایی بیشتر است.
نکته: انرژی فعالسازی نمی تواند منفی باشد. یکی از روش های تامین این انرژی، گرما دادن به واکنش دهنده ها است.
نکته: انرژی فعالسازی هر واکنش در جهت رفت، اختلاف سطح انرژی واکنش دهنده ها و قله ی مسیر (ناپایدارترین حالت در طول انجام واکنش) را نشان می دهد.
تاثیر کاتالیزگر بر انرژی فعالسازی:
برخی از واکنش ها در صنعت فقط در دما و فشار بالا انجام می شوند و تولید فرآورده ها درآن ها صرفه اقتصادی ندارد.از این رو شیمی دان ها درپی یافتن شرایط بهینه (دما و فشار پایین تر) برای انجام چنین واکنش هایی هستند. یکی از راه های انجام واکنش در فشار و دمای پایین و با سرعت مناسب، کاهش انرژی فعالسازی آن است، که با استفاده از کاتالیزگر امکان پذیر است.
نکته: کاتالیزگر ها با تغییر مسیر واکنش، Ea را کاهش داده و مسیر انجام واکنش را هموار می کنند. بنابراین، سرعت واکنش را در هر دو جهت افزایش می دهند.

ویژگی های کاتالیزگر مناسب:
1- کاتالیزگر اغلب اختصاصی و انتخابی عمل می کند.
2- در حضور کاتالیزگر نباید واکنش های ناخواسته ی دیگری انجام شود.
3- هر کاتالیزگر، نمی تواند همه ی واکنشها را سرعت ببخشد.
4- هر کاتالیزگر، یک یا شمار معدودی واکنش را سرعت می بخشد.
5- کاتالیزگر در شرایط انجام واکنش باید پایداری شیمیایی و گرمایی مناسب داشته باشد.
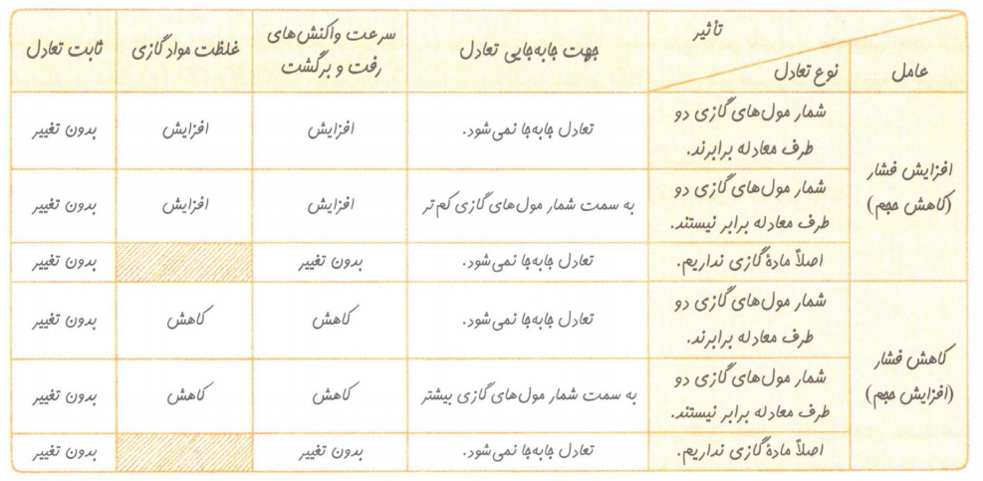
توجه: درکسر مربوط به تعادل، غلظت های تعادلی گونه ها قرار می گیرد. اگر غلظت هایی جز غلظت های تعادلی قرار بگیرد، مقدار کسر برابر با K و برای این کسر جدید دو حالت پیش می آید.
1- کوچکتر از K باشد؛ واکنش در جهت مصرف واکنش دهنده ها و تولید فرآورده ها (جهت رفت) پیش می رود تا به تعادل برسد.
2- بزرگتر از K باشد؛ تعادل در جهت مصرف فرآورده ها و تولید واکنش دهنده ها (جهت برگشت) پیش می رود تا به تعادل برسد.
نکته: اگرتغییری هم سبب به هم خوردن یک سامانه تعادلی شود، تعادل در جهتی جابه جا می شود که تا حد امکان (به صورت کامل یا ناقص) اثر آن تغییر را جبران کند. این توصیف از اصل لوشاتلیه است.
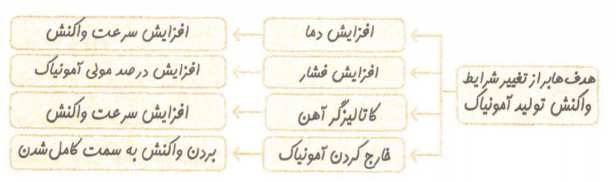
عوامل موثر بر تعادل عبارت اند از: 1-غلظت 2- فشار 3- دما
نکته: هنگامی که دمای یک سامانه تغییر می کند، پس از رسیدن به تعادل جدید افزون بر تغییر مواد،مقدار ثابت تعادل هم تغییر می کند و اینکه K زیاد یا کم شود به گرماگیر یا گرماده بودن واکنش بستگی دارد.
نکته: درتعادل های گرماده علامت q در سمت راست قراردارد. افزایش دما تعادل در جهت مصرف گرما جا به جا می کنند. بنابراین تعادل در جهت برگشت پیشروی می کند. به این ترتیب در تعادل های گرماده با افزایش دما مقدار K کم می شود.
نکته: برای تشخیص گرماگیر یا گرماده بودن تعادل هایی که نوع آن ها مشخص نشده، به مجموع تعداد مول های گازی در هرطرف معادله واکنش توجه کنید و علامت گرما q را همواره در سمت تعداد مول گازی کم تر قرار دهد.
نکته: تنها عامل موثر در مقدار K، دما است و کم و زیاد کردن غلظت و فشار، فقط جهت پیشروی تعادل را تعیین می کند.
توجه: کاتالیزگر زمان فرا رسیدن تعادل را کوتاه می کند. اما غلظت تعادلی گونه ها در حضور و عدم حضور کاتالیزگر یکسان خواهد بود. (زیرا سرعت واکنش های رفت و برگشت را به یک نسبت افزایش می دهد.)
توجه: اگرچه وجود مواد واکنش دهنده جامد یا مایع خالص برای برقراری تعادل الزامی است، اما کاستن یا اضافه کردن آن ها در جابه جا شدن تعادل تاثیری ندارد.
فناوری تولید آمونیاک به روش هابر

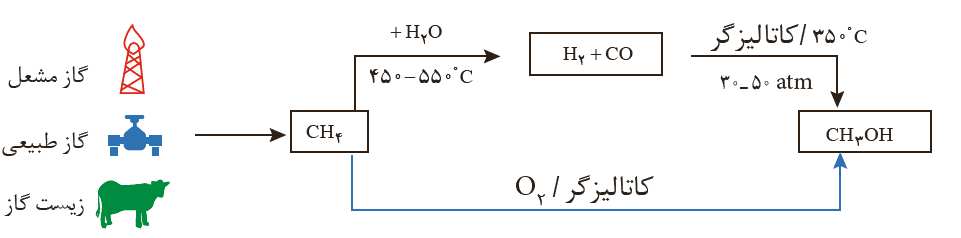
سنتز: یک فرآیند شیمیایی هدفمند است که در آن با استفاده از مواد ساده تر، مواد شیمیایی دیگر را تولید می کنند. در واقع سنتز را می توان کانون بسیاری از پژوهش های شیمیایی دانست که منجر به طراحی و تولید مواد جدید می شود.
نکته: ازواکنش مونومرهای سازنده این پلیمر یعنی اتیلن گلیکول (الکل دوعاملی) با ترفتالیک اسید (اسید دوعاملی) درشرایط مناسب می توان پلی اتیلن ترفتالات را سنتز کرد.
ویژگی پلاستیک ها:
چگالی کم
نفوذ ناپذیری نسبت به هوا و آب
ارزان بودن
مقاومت در برابرخوردگی
زیست تخریب ناپذیر
مراحل کلی بازیافت
1- بازیافت 2- انجام فرآیندهای فیزیکی وشیمیایی 3- تبدیل ماده ی اولیه به موادقابل استفاده
تست های منتخب؛ (تست های زیر را حل کنید و پاسخ آن ها را در کامنت ها به اشتراک بگذارید!)
تست 1
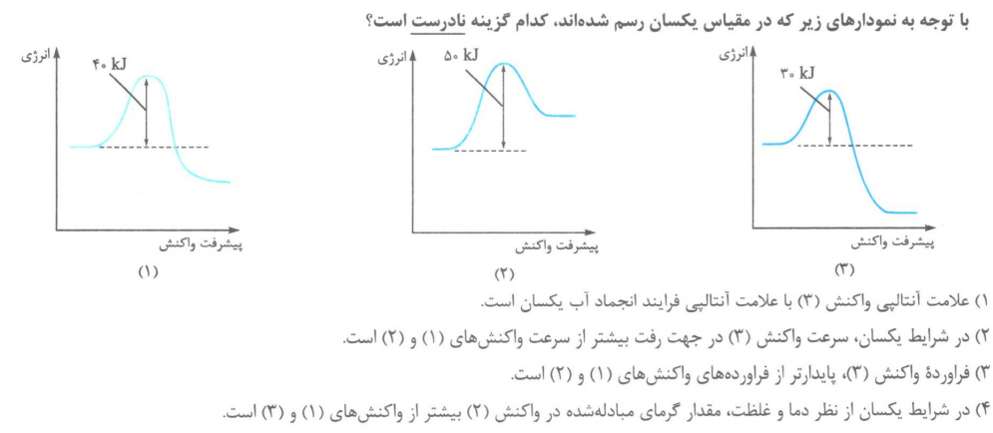
تست 2

تست 3

تست 4

تست 5

تست 6

تست 7

دوستان عزیز می توانید برای دسترسی به نسخه کامل خلاصه نکات به همراه پاسخ فایل پی دی اف زیر را دانلود کنید!
فراموش نکنید اگر سوالی در رابطه با این مبحث داشتید می توانید به راحتی در کامنت ها سوال خود را برای ما بنویسید.
دوستان عزیزم ما تصمیم گرفتیم برای اینکه بتونیم ارتباطمون رو با هم بیشتر کنیم و قدم به قدم کنارتون باشیم، صفحه ی اینستاگرام متا رو بسازیم
و همراهتون باشیم.
با آرزوی موفقیت و کامیابی
الهه پروری، فارغ التحصیل مهندسی شیمی دانشگاه تهران
نوید آرمات، دانشجوی مهندسی عمران دانشگاه تهران


