سلام دوستان عزیز
در این مطلب می خواهیم به جمع بندی خلاصه نکات و حفظیات صفحات 49 تا 75 شیمی یازدهم مطابق با بودجه بندی آزمون 6 اسفند که برای پاسخگویی به سوالات آزمون باید به آنها مسلط باشید، بپردازیم.
| دانشجوی مهندسی عمران دانشگاه تهران رتبه 328 منطقه دو - کنکور ریاضی 1398 |
برای ارتباط بیشتر با برترها و رزرو پشتیبان ویژه، پیج کانون برترها را دنبال کنید، همچنین میتونید با شماره ۰۲۱۸۴۵۱ داخلی ۳۱۲۳ تماس بگیرید.
بودجه بندی فصل دوم در کنکور سال های اخیر
غذا و ارتباط آن با دما، گرما و انرژی
نقش غذا در بدن علاوه بر رفع گرسنگی به صورت زیر است:
1- تامین انرژی مورد نیاز برای حرکت ماهیچه ها، ارسال پیام عصبی، جا به جایی یون ها و مولکولها از دیواره ی سلولی
2- ماده ی اولیه برای ساخت و رشد بخش های گوناگون بدن مانند سلول های خونی، استخوان، پوست، مو، ماهیچه ها، آنزیم ها و...
نکته: هر ماده ی غذایی انرژی دارد و میزان آن به جرمی که می سوزد بستگی دارد. این انرژی می تواند باعث تغییر دما شود.
دمای ماده از چه خبر می دهد؟
دما کمیتی است که میزان گرمی و سردی مواد را نشان می دهد. از دیدگاه ذره ای، ذره های سازنده ی ماده همواره در حال جنب و جوش هستند. اما در حالت های فیزیکی متفاوت، میزان جنبش ذرات متفاوت از یکدیگر است.
نکته: به طور کلی این جنبش های نامنظم در حالت گاز شدیدتر از مایع و در حالت مایع نیز شدیدتر از حالت جامد است.
در ضمن هر چه دما بالاتر می رود، این جنبش ها شدیدتر می شود. به همین دلیل بوی غذای گرم آسان تر و سریع تر از غذای سرد به مشام می رسد.
نکته:«دمای یک ماده معیاری برای توصیف میانگین تندی و میانگین انرژی جنبشی ذرات سازنده آن است.»
نکته: در دمای معین یک ویژگی مشترک مواد با هر حالتی، وجود جنبش های نامنظم ذرات سازنده ی آن هاست و هر چه دمای ماده بالاتر رود، میانگین تندی و میانگین انرژی جنبشی ذرات بیشتر است.
مجموع انرژی جنبشی ذرات سازنده ی یک نمونه ماده را انرژی گرمایی آن ماده می گویند. انرژی گرمایی، به دما و تعداد ذره های سازنده ی ماده (جرم ماده) وابسته است. به این ترتیب که هر چه دما و جرم جسمی بیشتر باشد، انرژی گرمایی آن نیز بیشتر است.
یکای رایج دما، درجه ی سلسیوس (℃) است، در حالی که یکای دما در «SI» کلوین (K) است. البته ارزش دمایی (℃1) برابر با (1K) است. از این رو در فرآیند هایی که دما تغییر می کند، ∆θ=∆T خواهد بود.
تفاوت دما و گرما
همانطور که می دانیم، انجام یک فرآیند می تواند باعث تغییر دمای یک ماده شود. به آن مقدار انرژی گرمایی که به دلیل تفاوت در دما جاری می شود، گرما می گویند.
•جهتِ جاری شدن انرژی گرمایی، از ماده ای با انرژی گرمایی بیشتر به ماده ای با انرژی گرمایی کم تر نیست، بلکه از ماده ای با دمای بالاتر (که ممکن است انرژی گرمایی کم تری داشته باشد) به ماده ای با دمای پایین تر می باشد.
•دما و انرژی گرمایی هر دو برای توصیف یک نمونه ماده به کار می روند، ولی گرما از ویژگی های یک نمونه ماده نیست. تغییر دما و گرما هر دو، برای توصیف یک فرآیند به کار می روند.
•گرما را با Q نشان می دهند، یکای اندازه گیری گرما در «SI» ژول (J) است ولی از کالری (cal) هم برای بیان مقدار گرما استفاده می شود.
1J = 1 kg.m2.s-2 1cal = 4.18 J
ظرفیت گرمایی و گرمای ویژه
به مقدار گرمای مورد نیاز برای افزایش دمای یک جسم به اندازه یک درجه سلسیوس، ظرفیت گرمایی آن جسم گویند که با حرف (C) نمایش داده می شود.
J.C-1 یا J.K-1 = یکای (C) Q=C∆θ
نکته: ظرفیت گرمایی یک ماده در دما و فشار ثابت به نوع ماده و مقدار آن بستگی دارد. بنابراین هر چه جرم جسمی بیش تر باشد، ظرفیت گرمایی آن نیز بیشتر است.
به مقدار گرمای لازم برای افزایش دمای یک گرم از یک جسم به اندازه ی (1℃) ظرفیت گرمایی ویژه آن جسم گفته می شود که با حرف (c) نمایش داده می شود. Q=mc∆θ

•دما با گرمای ویژه رابطهء عکس دارد. به طور کلی هر چه گرمای ویژهء ماده ای بزرگتر باشد، مقاومت آن در برابر تغییر دما بیشتر خواهد بود؛ یعنی دمای آن کم تر تغییر می کند.
•گرمای ویژهء آب از روغن زیتون بیشتر است؛ بنابراین به ازای جرم و تغییر دمای یکسان، آب نسبت به روغن زیتون گرمای بیشتری با محیط مبادله می کند. به همین دلیل است که اگر به دو ظرف فلزی یکسان که در دمایC 25 قرار دارند و حاوی جرم های برابری از آب و روغن هستند، گرما دهیم تا دمای هر دو به مقدار معینی (مثلا C 75) برسد و سپس در هر ظرف یک تخم مرغ بیندازیم، می بینیم که تخم مرغ در ظرف حاوی آب پخته می شود، اما روغن زیتون توانایی پختن تخم مرغ با این تغییر دما در همین بازه را ندارد؛ زیرا به ازای این تغییر دمای یکسان، آب گرمای بیشتری نسبت به روغن زیتون جذب می کند و همین گرمای بیشتر باعث پختن تخم مرغ می شود.
جاری شدن انرژی گرمایی
فرآیند هایی که با تبادل گرما همراه هستند به دو دسته تقسیم می شوند:
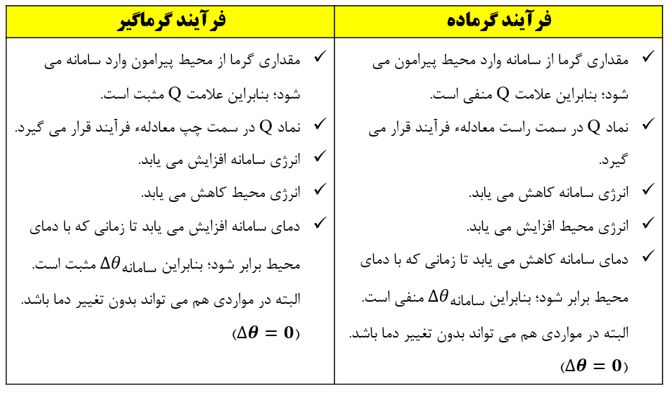
فرآیند های گرماده: در این فرآیند ها انرژی به صورت گرما از سامانه به محیط جاری می شود و دمای سامانه کاهش می یابد. Q<0
فرآیند های گرماگیر: در این نوع فرآیند ها انرژی به صورت گرما از محیط به سامانه منتقل می شود و دمای سامانه افزایش می یابد. Q>0
نکته: در فرآیند های گرماگیر علامت گرما در سمت واکنش دهنده ها و در فرآیند های گرماده علامت گرما در سمت فرآورده ها نوشته می شود.
تغییر حالت فیزیکی مواد خالص با تغییر انرژی همراه است. برخی از این تغییرها گرماگیر و برخی دیگر گرماده اند.
با توجه به شکل بالا می توان نتیجه گرفت که:
* انرژی یک ماده در حالت گاز بیشتر از حالت مایع و آن هم بیشتر از حالت جامد است.
جامد < مایع < گاز: انرژی
* برای یک مادهء خالص، میزان تغییر انرژی در دو فرآیند تبخیر و میعان، دو فرآیند انجماد و ذوب و هم چنین دو فرآیند فرازش و چگالش با هم برابر است؛ به طور مثال انرژی مورد نیاز برای تبخیر مقدار معینی آب با مقدار انرژی آزاد شده از میعان همان مقدار آب، یکسان است.
* تفاوت انرژی یک ماده در حالت های مایع و گاز بیشتر از تفاوت آن ماده در حالت های جامد و مایع است. (مایع – جامد) < (گاز – مایع) » تفاوت انرژی
* بنابراین می توان گفت انرژی مورد نیاز برای تبخیر مقدار معینی از یک ماده به حالت مایع، بیشتر از انرژی مورد نیاز برای ذوب همان مقدار ماده به حالت جامد است.
واکنش گرماده و گرماگیر
به شاخه ای از علم شیمی که به بررسی کمی و کیفی گرمای واکنش های شیمیایی، تغییر آن و تاثیری که بر حالت ماده دارد، ترموشیمی یا گرماشیمی می گویند.
واکنش ها بر نیز بر اساس این که در طی واکنش گرما آزاد شده یا گرما جذب شود، به دو دسته تقسیم می شوند:
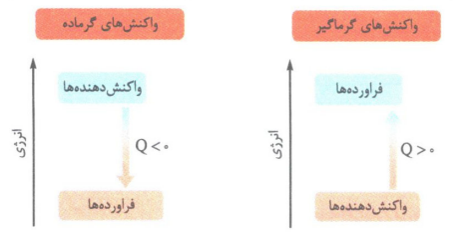
انرژی یک سامانه با پایداری آن رابطهء عکس دارد؛ به عبارت دیگر هر چه انرژی سامانه بیشتر باشد، آن سامانه ناپایدارتر است.

مبادله گرما بر اثر انجام واکنش در دمای ثابت
اگر یک واکنش در دمای ثابت انجام شود، یعنی دمای مواد واکنش دهنده پیش از آغاز واکنش با دمای مواد فراورده پس از پایان واکنش برابر باشد، باز هم میان سامانه واکنش و محیط پیرامون، گرما دادوستد خواهد شد. شیمیدان ها گرمای جذب یا آزاد شده در هر واکنش شیمیایی را به طور عمده وابسته به تفاوت میان انرژی پتانسیل مواد واکنش دهنده و فراورده می دانند. انرژی پتانسیل یک نمونه ماده، انرژی نهفته در آن بوده و هم ارز با انرژی ناشی از نیروهای نگهدارنده ذره های سازنده آن است.
•گرمای جذب یا آزاد شده در واکنشی که در دمای ثابت انجام می شود، ناشی از تفاوت انرژی گرمایی (مجموع انرژی جنبشی ذره ها) در مواد واکنش دهنده و فراورده نیست؛ زیرا در دمای ثابت، تفاوت چشمگیری میان انرژی گرمایی آنها وجود ندارد.
•با انجام یک واکنش شیمیایی، شیوه اتصال اتم ها به یکدیگر تغییر می کند و همین امر باعث تفاوت آشکاری در انرژی پتانسیل وابسته به آنها شده و این تفاوت انرژی، در واکنش به شکل گرما ظاهر می شود.
• الماس و گرافیت دو دگرشکل (آلوتروپ) معروف کربن هستند. شیوه اتصال اتم های کربن به یکدیگر در این دو آلوتروپ متفاوت است؛
عوامل موثر بر گرمای واکنش
1- نوع مواد واکنش دهنده و فرآورده: هر ماده در دما و فشار ثابت، انرژی معینی دارد، یعنی سطح انرژی مواد با هم متفاوت است؛ بنابراین گرمای واکنش ها با تغییر نوع ماده، تغییر می کند.
2- دما و فشار: سطح انرژی مواد به دما و فشار بستگی دارد؛ بنابراین برای تعیین گرمای یک واکنش، باید واکنش مورد نظر در یک فشار معین و دمای ثابت انجام شود.
3- مقدار واکنش دهنده ها: هر چه مقدار مواد واکنش دهنده بیشتر باشد، مقدار گرمای مبادله شده نیز بیشتر خواهد بود.
4- حالت فیزیکی واکنش دهنده ها و فرآورده ها: حالت فیزیکی مواد شرکت کننده در یک واکنش باید مشخص باشد، زیرا انرژی مواد در حالت های فیزیکی مختلف، متفاوت است. به طور کلی سطح انرژی یک ماده در حالت گاز بیشتر از حالت مایع و آن هم بیشتر از حالت جامد می باشد.
جامد < مایع < گاز : سطح انرژی یک ماده در حالت های فیزیکی مختلف
تست 1: (ساده - کانون قلم چی (سال 96))
تست 2: (سخت – المپیاد شیمی 96)

تست 3: (سراسری ریاضی خارج از کشور 94)

مفهوم آنتالپی
انرژی کل یک سامانه هم ارز با محتوی انرژی یا آنتالپی آن می باشد. بنابراین هر سامانه در دما و فشار ثابت آنتالپی معینی دارد.
در واکنش های گرماگیر مواد با آنتالپی کم تر به مواد با آنتالپی بیش تر تبدیل می شوند.
در واکنش های گرماده مواد با آنتالپی بیش تر به مواد با آنتالپی کم تر تبدیل می شوند.
انجام واکنش همراه با داد و ستد انرژی در واکنش ها همراه است که این انرژی به شکل گرما ظاهر می شود. تغییر آنتالپی هر واکنش هم ارز با گرمایی است که در فشار ثابت با محیط مبادله می شود و با QP نمایش داده می شود.
نکته: واکنش های رفت و برگشت قرینه یکدیگر هستند.
استوکیومتری∆H
برای محاسبه مقدار گرمای خواسته شده ابتدا مقدار ماده را به مول تبدیل می کنیم سپس با استفاده از کسر تبدیل مناسب مقدار مول را به گرما (کیلوژول) تبدیل می کنیم.
آنتالپی پیوند و میانگین آن
به مقدار انرژی لازم برای شکستن یک مول از پیوند های اشتراکی در حالت گازی و تبدیل آن ها به اتم های سازنده گازی شکل، آنتالپی پیوند گفته می شود. . به عنوان مثال برای شکستن پیوندهای موجود در یک مول (H2)g و تبدیل آن به دو مول اتم هیدروژن گازیkJ ٤٣٦ انرژی لازم است. بنابراین از آنجا که شکستن یک پیوند همواره گرماگیر است آنتالپی آن همیشه مثبت است.
نکته: در مولکول هایی مانند NH3، CH4، H2O که اتم مرکزی در آن ها به چند اتم یکسان با پیوند اشتراکی متصل است. از واژه میانگین آنتالپی پیوند استفاده می شود چون انرژی لازم برای شکستن این پیوند ها یکسان نیست.
نکته: آنتالپی واکنش تشکیل پیوند قرینه آنتالپی پیوند است.
نکته: آنتالپی پیوند های متفاوت به دو عامل وابسته است:
1) مرتبه پیوند (تعداد پیوند های بین دو اتم): هر چه مرتبه پیوند بیش تر باشد، انرژی پیوند بیش تر است.
2) شعاع اتم های تشکیل دهنده پیوند: هرچه شعاع اتم های تشکیل دهنده پیوند بیش تر باشد، آنتالپی پیوند کوچک تر است. نکته: هم چنین در یک پیوند هرچه اختلاف الکترونگاتیوی بین دو اتم بیش تر باشد قطبیت پیوند بیش تر شده و جاذبه بین دو اتم قوی تر می شود لذا انرژی پیوند افزایش می یابد.
نکته: در اندازه گیری آنتالپی پیوند، همه مواد (واکنش دهنده ها و فراورده ها) باید گازی شکل باشند زیرا اگر ماده اولیه در حالت جامد یا مایع باشد باید مقداری انرژی صرف غلبه بر نیروهای بین ذره ای آن کرد. به عبارت دیگر مقداری انرژی صرف تبخیر یا ذوب آن ماده می شود که این امر اندازه گیری آنتالپی پیوند را دچار خطا می کند.
آنتالپی پیوند، برای محاسبه تغییرات آنتالپی واکنش
(شده تشکیل های پیوند آنتالپی مجموع) - ( شده شکسته های پیوند مجموع) = واکنش ∆
آنتالپی سوختن:
سوختن تغییر شیمیایی است که طی آن یک ماده به سرعت واکنش می دهد و انرژی زیادی به صورت گرما آزاد می کند. آنتالپی واکنشی را که در آن یک مول از ماده در مقدار اکسیژن کافی بسوزد، آنتالپی سوختن آن ماده می نامند که دارای واحد کیلوژول بر مول و علامت منفی است.
نکته: یکی از فرآورده های سوختن مواد آلی به صورت H2O است که به صورت مایع است.
نکته: هر چه جرم هیدروکربنی بیش تر باشد، گرمای حاصل از سوختن آن بیش تر است.
نکته: گرمای حاصل از سوختن آلکان ها از الکل های هم کربن خودشان بیش تر است.
نکات حفظی:
1- سوخت های سبز در ساختار خود علاوه بر هیدروژن و کربن، اکسیژن نیز دارند و از پسماند های گیاهی مانند سویا، نیشکر و دیگر دانه های روغنی اسخراج می شوند. بنابراین اتانول نیز سوخت سبز به شمار می رود.
2- هرگاه بدن نیاز فوری به انرژی داشته باشد، مصرف موادی که کربوهیدرات زیادی دارند، توصیه می شود.
3- هرگاه بدن برای انجام فعالیت های فیزیکی در مدت طولانی نیاز به انرژی داشته باشد مصرف موادی که چربی بیشتری دارند توصیه می شود.
گرمای آزاد شده یا جذب شده در فرآیند های فیزیکی و شیمیایی به دو روش غیر مستقیم و مستقیم قابل اندازه گیری است.
روش مستقیم: در این روش از دستگاهی به نام گرماسنج استفاده می شود، مقدار معینی از واکنش دهنده ها در شرایط مناسب بر هم اثر می دهند و گرمای مبادله شده در واکنش را بطور مستقیم اندازه گیری می کنند. گرماسنج لیوانی نمونه ساده ای از یک گرماسنج است که از دو لیوان یک بار مصرف که عایق گرما هستند ساخته شده و دارای درپوش یونولیتی است. ( در آن دماسنج و همزن هم تعبیه شده است.)
در این سامانه ابتدا مقدار معینی آب یا محلول ریخته و دمای ابتدایی آن تعیین می شود. پس از افزودن ماده دوم به آن و انجام واکنش دمای پایانی و در پی آن تغییر دما مشخص می شود.
در نهایت با استفاده از جرم مواد و گرمای ویژه آن ها و با استفاده از رابطه Q=mc∆T مقدار گرمای واکنش به ازای مقدار معینی ماده محاسبه می شود.
این گرماسنج گرمای واکنش را در فشار ثابت اندازه گیری می کند در نتیجه گرمای بدست آمده همان تغییر آنتالپی است.
روش غیر مستقیم: آنتالپی بسیاری از واکنش ها را نمی توان به روش مستقیم اندازه گیری کرد، زیرا برخی از آن ها مرحله ای از یک واکنش پیچیده هستند. به همین دلیل از روش های غیر مستقیم استفاده می شود که یکی از آن ها قانون هس می باشد.
اساس این روش بر آن است که گرمای واکنش به مسیر انجام واکنش بستگی ندارد، در نتیجه اگر بتوان واکنشی را از جمع دو یا چند واکنش دیگر بدست آورد، تغییر آنتالپی آن نیز جمع تغییرات آنتالپی واکنش ها است.
نکته: با ضرب کردن یک واکنش در عددی آنتالپی آن نیز در همان عدد ضرب می شود.
نکته: با قرینه کردن یک واکنش، آنتالپی آن نیز قرینه می شود.
گروه های عاملی مهم اکسیژن دار
گروه کربونیل
این گروه عاملی مختص آلدهید ها و کتون هاست. در آلدهید ها این گروه عاملی در ابتدای زنجیره کربنی قرار می گیرد و از یک سمت حتما به H متصل است. مانند بنزآلدهید. ولی در کتون ها این گروه عاملی از هر دو سمت به کربن متصل است.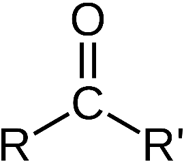
گروه هیدروکسیل
این گروه عاملی مختص الکل ها است. مانند ترکیب آلی موجود در گشنیز که سبب طعم و بوی آن می شود.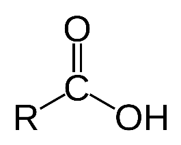
گروه اتری
این گروه مختص اتر هاست. مانند ترکیب آلی موجود در رازیانه که موجب ایجاد طعم و بوی آن می شود.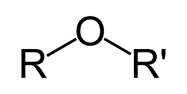
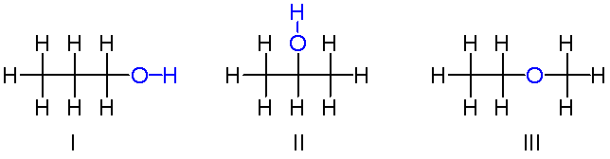
ایزومر
به موادی که فرمول مولکولی یکسان ولی ساختار متفاوتی دارند، ایزومر یا هم پار گفته می شود.
ایزومر ها دارای خواص فیزیکی و شیمیایی متفاوتی هستند و محتوی انرژی آن ها نیز با هم متفاوت است.
نکته: آلدهید ها و کتون های سیر شده و هم کربن ایزومر هستند.
نکته: الکل ها و اترهای سیر شده و هم کربن نیز ایزومر هستند.
تست 4: (متوسط - سراسری خارج از کشور ریاضی 93)
اگر آنتالپی پیوندهای C-H، C-O، O-H، C=O، O=O، به ترتیب برابر 412، 360، 463، 805 و 496 کیلوژول بر مول باشد، گرمای آزاد شده در واکنش سوختن 8 گرم بخار متانول با فرآورده های گازی، برابر چند کبلوژول است؟ (O=16; C=12; H=1g.mol-1)
1) 154.15 2) 144.5 3)172.25 4) 164.75
تست 5: ( متوسط - کانون قلم چی (سال 97))

تست 6: ( سخت - کانون قلم چی (سال 95))

دوستان عزیز می توانید برای دسترسی به نسخه کامل خلاصه نکات به همراه پاسخ فایل پی دی اف زیر را دانلود کنید!
فراموش نکنید اگر سوالی در رابطه با این مبحث داشتید می توانید به راحتی در کامنت ها سوال خود را برای ما بنویسید.
دوستان عزیزم؛ برای ارتباط با رتبه برترها صفحه اینستاگرام زیر رو دنبال کنید.
با آرزوی موفقیت و کامیابی




