سلام دوستان عزیز
در این مطلب می خواهیم به جمع بندی خلاصه نکات و حفظیات فصل دوم شیمی یازدهم مطابق با بودجه بندی آزمون 8 بهمن که برای پاسخگویی به سوالات آزمون باید به آنها مسلط باشید، بپردازیم.
| دانشجوی مهندسی عمران دانشگاه تهران رتبه 328 منطقه دو - کنکور ریاضی 1398 |
برای ارتباط بیشتر با برترها و رزرو پشتیبان ویژه، پیج کانون برترها را دنبال کنید، همچنین میتونید با شماره ۰۲۱۸۴۵۱ داخلی ۳۱۲۳ تماس بگیرید.
دسته بندی عنصر ها و ویژگی های هر دسته
با بررسی رفتار و خواص عناصر می توان عناصر جدول دوره ای را به 3 دسته تقسیم کرد:
1- فلز ها
بیش تر عناصر جدول دوره ای را تشکیل می دهند که دارای خواص زیر می باشند:
-به طور عمده در سمت چپ و مرکز جدول قرار دارند.
- اغلب دارای سطح براق و صیقلی هستند.
- اغلب جامد هایی شکل پذیر هستند.
-در واکنش با دیگر عنصر ها الکترون از دست می دهند.
-در اثر ضربه تغییر شکل می دهند اما خرد نمی شوند (قابلیت چکش خواری، شکل پذیری)
-مانند Na, Mg, Al, Sn, Pb
نکته: همه ی فلزات جدول جامد و تک اتمی هستند به جز جیوه (Hg) که تنها فلز مایع است.
2- نافلز ها:
-به طور عمده در سمت راست و بالای جدول دوره ای قرار دارند.
- در واکنش با دیگر اتم ها، الکترون به اشتراک می گذارند یا می گیرند.
- سطح آن ها در حالت جامد درخشان نبوده و کدر هستند.
- جریان برق و گرما را عبور نمی دهند، به جز کربن که رسانای الکتریسیته است.
- در حالت جامد در اثر ضربه خرد می شوند. (شکننده)
- مانند کربن C6, فسفر P15 ,گوگرد S16 ,کلر Cl17
3- شبه فلز ها:
- عناصری هستند که همانند مرزی بین فلز ها و نافلزها قرار دارند.
- خواص فیزیکی آن ها بیش تر به فلزها شبیه است در حالی که رفتار شیمیایی آن ها همانند نافلزهاست.
- اغلب رسانایی الکتریک کمی دارند(نیمه رسانا)
- در واکنش با دیگر اتم ها الکترون به اشتراک می گذارند.
- معمولا شکننده هستند و بر اثر ضربه خرد می شوند. Si14, 32Ge
خصلت فلزی و نافلزی
خصلت فلزی به معنای ویژگی های فیزیکی و شیمیایی مربوط به فلز می باشد که در یک گروه از بالا به پایین، افزایش می یابد.
توجه: هر چه یک فلز، تمایل بیش تری به از دست دادن الکترون های ظرفیتی خود داشته باشد، واکنش پذیری و خصلت فلزی آن بیش تر است.
به عنوان مثال: Fr > Cs > Rb > K > Na > Li : خصلت فلزی
خصلت نافلزی به معنای ویژگی های فیزیکی و شیمیایی مرتبط به نافلزها می باشد که در یک گروه از بالا به پایین، کاهش می یابد.
توجه: هر چه یک نافلز، تمایل بیش تری برای گرفتن الکترون داشته باشد، واکنش پذیری و خصلت نافلزی بیش تری دارد.
به عنوان مثال: F > Cl > Br > I > At خصلت نافلزی
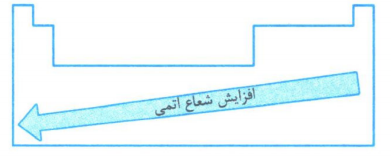
شعاع اتمی
به طور کلی هر چه شعاع یک اتم بزرگتر باشد، اندازه آن اتم نیز، بزرگتر است.
به طورکلی، شعاع اتمی عنصرهای جدول دوره ای در یک گروه از بالا به پایین افزایش می یابد؛ زیرا تعداد لایه های الکترونی بیش تر می شود.
به طور کلی در یک دوره شعاع اتمی از چپ به راست کاهش می یابد؛ زیرا در یک دوره تعداد لایه های الکترونی ثابت می ماند؛ در حالی که تعداد پروتون های هسته بر الکترون ها بیش تر شده و شعاع اتم کاهش می یابد.
در بین تمام عناصر جدول دوره ای، عنصر Fr دارای بیش ترین و عنصر H دارای کم ترین شعاع اتمی است.
با توجه به روند تغییر شعاع اتمی در یک گروه و دوره، هر چه عنصری در جدول دوره ای، سمت چپ تر و پایین تر، شعاع آن بزرگتر است و بالعکس.
فلزات واسطه
دسته ای از عناصر جدول دوره ای می باشند که در مرکز جدول دوره ای قرار دارند و زیر لایه d در آن ها در حال پر شدن است و دارای خصوصیات زیر هستند:
1- همگی فلز هستند و دارای رسانایی الکتریکی و گرمایی می باشند.
2- اغلب این فلز ها در طبیعت به شکل ترکیب های یونی مانند اکسیدها، کربنات ها و .... یافت می شوند.
3- یون های فلزات واسطه و ترکیبات یونی دارای این یون ها اغلب رنگی هستند. به عنوان مثال یون مس II ، آبی رنگ است.
4- مهم ترین فلزات واسطه مربوط به دوره ی چهارم جدول دوره ای هستند که عدد اتمی آن ها 21 تا 30 می باشد.
تست 1:

مقایسه ی واکنش پذیری عناصر
واکنش پذیری هر عنصر به معنای تمایل اتم آن به انجام واکنش شیمیایی است. هر چه واکنش پذیری اتم های عنصری بیشتر باشد، در شرایط یکسان تمایل آن برای انجام واکنش و تبدیل شدن به ترکیب بیشتر است.
در هر واکنش شیمیایی که به طور طبیعی انجام می شود، واکنش پذیری فرآورده ها از واکنش دهنده ها کمتر است؛ پس اگر یک واکنش به ما بدهند که در دو طرفش به عنصر آزاد وجود داشته باشد و بگن که این واکنش به طور طبیعی انجام میشه، ما خیلی سریع می تونیم واکنش پذیری دو عنصر آزاد در دو طرف معادله را با هم مقایسه کنیم:
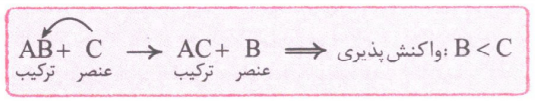
در معادله کلی بالا، واکنش پذیری Cاز Bبیشتر بوده است؛ به همین دلیل میل بیشتری به تشکیل ترکیب داشته؛ از این رو با انجام واکنش، جاشو باB عوض می کند.
تست 2:

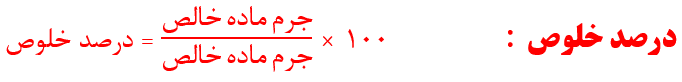
در مسائل استوکیومتری واکنش ها با چاشنی درصد خلوص، با یکی از این چهار حالت زیر می شویم:
حالت اول:
مقدار گرم خالص یک ماده موجود در واکنش را می دهند و مقدار گرم ناخالص یک ماده دیگر را می خواهند. در این جا ابتدا مقدار گرم خالص ماده داده شده را با محاسبات استوکیومتری به مقدار گرم خالص ماده خواسته شده تبدیل می کنیم و سپس با توجه به درصد خلوص مادة خواسته شده، به راحتی می توان مقدار گرم ناخالص آن را به دست آورد.
حالت دوم:
در این حالت، مقدار گرم ناخالص یک ماده موجود در واکنش را می دهند و مقدار گرم خالص یک ماده دیگر را می خواهند. برای حل این مسائل به روش کسر تبدیل، ابتدا با توجه به درصد خلوص ماده داده شده، مقدار گرم خالص آن را به دست می آوریم و سپس با محاسبات استوکیومتری، مقدار گرم خالص ماده خواسته شده را حساب می کنیم. برای حل به روش تناسب، فقط کافیه که در تناسب مربوط به ماده موردنظر، درصد خلوص را در مقدار داده شده ضرب کنید.
حالت سوم:
این گونه مسائل در واقع ترکیبی از مسائل حالت اول و حالت دوم هستند، به طوری که مقدار گرم ناخالص یک مادهء موجود در واکنش را می دهند و مقدار گرم ناخالص یک مادهء دیگر را می خواهند.
حالت چهارم:
در این حالت، از ما درصد خلوص یکی از مواد ناخالص موجود در واکنش را می پرسند. در این جا با توجه به مقدار گرم خالص یکی از موادی که به ما داده است، مقدار گرم خالص مادهء مورد نظر را به دست می آوریم؛ سپس آن را در رابطهء درصد خلوص گذاشته و درصد خلوص این ماده را حساب می کنیم.

به مقدار فرآورده مورد انتظار در هر واکنش، مقدار نظری و به مقدار فرآورده ای که در عمل تولید می شود، مقدار عملی گفته می شود.
در مسائل استوکیومتری واکنش ها با چاشنی بازده درصدی، با یکی از این سه حالت زیر می شویم:
حالت اول:
در این گونه مسائل خواستهء مسئله، به دست آوردن بازده درصدی است. در این حالت مقدار فرآورده ای که در واکنش داده شده، همان مقدار عملی است.خب مقدار نطری فرآورده با داده های دیگر مسئله به دست آورده و مقدار عملی و نظری را در رابطهء بازده درصدی قرار می دهیم و تمام.
حالت دوم:
در این گونه مسائل، مقدار واکنش دهنده را می دهند و از ما مقدار عملی یک فرآورده را می خواهند. در این جا ابتدا باید با استفاده از محاسبات استوکیومتری، مقدار نظری فرآورده را حساب کرد؛ سپس با استفاده از مقدار نظری به دست آمده و بازده درصدی، مقدار عملی فرآورده را حساب کرد.

حالت سوم:
در این گونه مسائل، مقدار عملی یک فرآورده را می دهند و مقدار واکنش دهنده(ها) را می خواهند. در این حالت ابتدا با استفاده از مقدار عملی و بازده درصدی واکنش، مقدار نظری فرآورده را حساب می کنیم؛ سپس با استفاده از مقدار نظری به دست آمده و محاسبات استوکیومتری، مقدار مورد نیاز از واکنش دهنده(ها) را به دست آوریم:
تست 2:
اگر 25 گرم کلسیم کربنات با خلوص 80 درصد بر اثر گرما طبق واکنش CaO + CO2 CaCO3 →به میزان 60 درصد تجزیه شود، چند لیتر گاز کربن دی اکسید در شرایط STP آزاد می شود؟ C=12 g.mol-1) وO=16 و Ca=40)
1- 2.688 2- 3.455 3- 4.226 4- 5.344
آشنایی با نفت خام
نفت خام دو نقش اساسی دارد:
1) منبع تأمین انرژی است: حدود نیمی از نفتی که از چاه های نفت، بیرون کشیده می شود، به عنوان سوخت در وسایل نقلیه به کار می رود. بخش اعظم از نیم دیگر آن برای تأمین گرما و انرژی الکتریکی مورد نیاز ما به کار می رود.
2) ماده اولیه برای تهیه بسیاری از مواد مانند الياف، پارچه، شوینده ها و ... است. و روزانه بیش از ۸۰ میلیون بشکه نفت خام در دنیا به شکل های گوناگون مصرف می شود. هر بشکه نفت خام هم ارز با ۱۵۹ لیتر است.
کربن
عنصر اصلی سازندهء نفت خام، کربن است. همانطور که می دانید این عنصر در خانهء شماره 6 جدول دوره ای قرار دارد. ترکیب های شناخته شده از اتم کربن، از مجموع ترکیبهای شناخته شده از دیگر عنصرهای جدول دوره ای بیشتر است.
اتم کربن در دورهء دوم و گروه 14 جدول دوره ای قرار دارد. این اتم در لایهء ظرفیت خود 4 الکترون داشته و می تواند از طریق
به اشتراک گذاشتن همهء الکترون های ظرفیت خود و با تشکیل چهار پیوند اشتراکی به آرایش هشت تایی برسد.

کربن
عنصر اصلی سازندهء نفت خام، کربن است. همانطور که می دانید این عنصر در خانهء شماره 6 جدول دوره ای قرار دارد. ترکیب های شناخته شده از اتم کربن، از مجموع ترکیبهای شناخته شده از دیگر عنصرهای جدول دوره ای بیشتر است.
اتم کربن در دورهء دوم و گروه 14 جدول دوره ای قرار دارد. این اتم در لایهء ظرفیت خود 4 الکترون داشته و می تواند از طریق
به اشتراک گذاشتن همهء الکترون های ظرفیت خود و با تشکیل چهار پیوند اشتراکی به آرایش هشت تایی برسد.
آلکان ها
آلکان ها دسته ای از هیدروکربن ها هستند ک در آن ها هر اتم کربن با چهار پیوند یگانه به اتم های اطراف متصل شده است. فرمول عمومی آنها به صورت CnH2n+2 می باشد و جرم مولی آن ها از رابطه 14n+2 به دست می آید.
آلکان ها به دلیل داشتن پیوند های یگانه، تمایلی به انجام واکنش ندارند و سیر شده هستند و گشتاور دو قطبی آن ها حدود صفر است.
آلکان ها هیدورکربن هایی هستند که به دلیل داشتن پیوند های یگانه، تمایلی به انجام واکنش ندارند و سیر شده می باشند. به همین دلیل میزان سمی بودن آن ها کمتر شده و استنشاق آن ها بر شش ها و بدن تاثیر چندانی ندارد و فقط سبب کاهش مقدار اکسیژن در هوای دم می شوند. از این رو هیچ گاه برای برداشتن بنزین از مکیدن شلنگ استفاده نکنید؛ چون بخار های بنزین وارد شش ها شده و از انتقال گاز های تنفسی در شش ها جلوگیری می کند و نفس کشیدن دشوار می شود.
تجربه نشان می دهد که گشتاوردوقطبی آلکان ها حدود صفر است. بنابراین ناقطبی بوده و در آب نامحلول اند.
این ویژگی باعث می شود از آن ها برای حفاظت از فلزها استفاده شود. به این ترتیب که فلزها را در آلکان های مایع قرار می دهند و یا سطح فلزها را با آلکان ها، اندود می کنند تا از خوردگی فلز جلوگیری شود.
نقطه جوش: به طور کلی با افزایش تعداد اتم های کربن و افزایش جرم مولی آن ها نیروی بین مولکولی که از نوع وان دروالسی است، قوی تر شده و نقطه جوش افزایش می یابد.
فرار بودن: به طور کلی هر چه نقطه جوش پایین تر باشد میزان فرار بودن آلکان ها نیز بیشتر است. بنابراین هر چه تعداد اتم های کربن کمتر باشد(جرم مولی کمتر)، فرار بودن آلکان بیشتراست.
گران روی: به طور کلی هر چه تعداد اتم های کربن در آلکان ها بیشتر باشد، گران روی آلکان نیز بیشتراست.
آلکان ها با توجه به نحوه قرار گرفتن اتم های کربن موجود در آن ها به دو دسته زیر تقسیم می شوند:
1- آلکان ها راست زنجیر: در این نوع آلکان ها، هر اتم کربن به یک یا دو اتم کربن دیگر متصل شده است.
2- آلکان های شاخه دار: در این آلکان ها، برخی کربن ها به سه یا چهار اتم کربن دیگر متصل اند.
آلکیل ها: اگر یک اتم H از فرمول آلکان ها کم کنیم گروهی جدیدی به نام آلکیل ها با فرمولCnH2n+1 به دست می آید. مانند متیل (CH3) و اتیل (C2H5)
توجه: برای رسم ساختار آلکان های راست زنجیر مانند هگزان (C6H6) می توان به تعداد اتم های کربن موجود در فرمول، اتم های C را با پیوند یگانه به هم وصل کرد و تا رسیدن به 4 پیوند برای هر اتم کربن، به آن ها اتم های هیدروژن متصل کرد. به طور مثال در این جا خواهیم داشت:

در دو سر زنجیر آلکان های راست زنجیر، 2 گروه CH3، وجود دارد و در وسط زنجیر فقط CH2 داریم؛ بنابراین می توان ساختار هگزان را به یکی از 3 حالت زیر نیز نشان داد:
یکی دیگر از روش های نمایش هیدروکربن ها، روش «پیوند – خط» است. در این روش، پیوند های کربن – کربن را با خط نشان می دهند، اما اتم های هیدروژن نشان داده نمی شوند.

از آنجا که هر اتم کربن، چهار الکترون و هر اتم هیدروژن، یک لکترون به اشتراک میگذارد و از طرفی هر پیوند اشتراکی شامل 2 الکترون است، تعداد پیوندهای اشتراکی در هیدروکربن ها از رابطهء زیر به دست می آید:
در ضمن شمار پیوندهای «C-H» در هیدروکربن ها برابر با شمار اتم های هیدروژن آن ها است.
مثال: تعداد پیوندهای اشتراکی در یک آلکان n کربنی (CnH2n+2) برابر (3n+1) است.
•در هر آلکان با n کربن، (n-1) پیوند کربن – کربن (C-C) و (2n+2) پیوند کربن – هیدروژن (C-H) وجود دارد. بنابراین برای رسم ساختار پیوند – خط یک آلکان با n اتم کربن، به (n-1) خط نیاز است.
تست 3:
اگر نسبت شمار اتم های هیدروژن به کربن در آلکانی راست زنجیر برابر 2.4 باشد، چند مورد از مطالب زیر دربارهء آن درست است؟ (C=12 , H=1 : g.mol-1)
•این آلکان در دمای اتاق به حالت گازی است.
•نقطهء جوش آن از نقطهء جوش بوتان کم تر است.
•تفاوت جرم مولی آن با جرم مولی ساده ترین آلکان برابر 42 گرم است.
•شمار اتم های هیدروژن در آن دو برابر شمار اتم های هیدروژن در اتان است.
1) 4 2) 3 3) 2 4) 1
آلکن ها
این هیدروکربن ها در ساختار خود دارای پیوند دوگانه کربن = کربن هستند. فرمول عمومی آن ها به صورت C(n) H(2n) می باشد و جرم مولی آن ها از رابطه 14n به دست می آید. ساده ترین آلکن دارای ( 2=n) می باشد. پس دارای فرمول C(2)H(4) و نام اتن است.
این ماده در بیش تر گیاهان وجود دارد. موز و گوجه فرنگی رسیده گاز اتن آزاد می کنند که موجب سریع تر رسیدن میوه های نارس می شود. به همین دلیل در کشاورزی از گاز اتن به عنوان «عمل آورنده» استفاده می شود.
الف) واکنش آلکن ها با آب: در این واکنش الکل تولید می شود. به عنوان مثال با وارد کردن گاز اتن در مخلوط آب و اسید در شرایط مناسب، اتانول (الکل دو کربنه) در مقیاس صنعتی تولید می شود.
ب) واکنش آلکن ها با برم مایع: در این واکنش، پیوند دوگانه میان کربن ها شکسته و دو پیوند جدید بین اتم های کربن و اتم های کربن و اتم های Br (برم) ایجاد می شود. به عنوان مثال بر اثر واکنش برم مایع با گاز اتن، ترکیب سیر شده 2،1- دی برومو اتان به دست می آید.
پ) پلیمر شدن آلکان ها: این واکنش ها در فصل سوم مورد بررسی قرار می گیرند که برای تولید انواع لاستیک ها، پلاستیک ها و الیاف به کار می رود.
ت) واکنش آلکن با گاز هیدروژن: در این واکنش آلکن ها با گاز هیدروژن(H2) در حضور کاتالیزگر نیکل (Ni) واکنش داده و به آلکان تبدیل می شود.
آلکین ها
هیدروکربن های سیر نشده ای هستند که در ساختار خود یک پیوند سه گانه کربن – کربن(C≡C) دارند. فرمول عمومی آن ها به صورت CnH(2n2) می باشد. که رد آن ها ... و 3 و 2= n است. جرم مولی آن ها از رابطه 14n-2 به دست می آید.
ساده ترین آن ها اتین (C2H2) است و برای نام گذاری سایر آن ها مانند آلکن ها عمل می شود. با این تفاوت که انتهای نام زنجیر اصلی از پسوند «ین» به جای « ِ ن» استفاده می شود.
آلکین ها از آلکان های هم کربن، 4 اتم هیدروژن کم تر و از آلکن های هم کربن، 2 اتم هیدروژن کم تر دارند. پس سیر نشده محسوب می شوند. البته واکنش پذیری آن ها از آلکن ها بیش تر است، چون سیر نشده تر از آلکن ها هستند.
آلکان < آلکن < آلکین :واکنش پذیری
هیدرو کربن های حلقوی
ترکیب های آلی بسیاری شناخته شده اند که در آن ها از اتصال 3 کربن، ساختاری حلقوی به وجود می آید.
هیدروکربن های حلقوی می توانند سیر شده یا سیر نشده باشند. به عنوان مثال سیکلو آلکان ها، سیرشده و ترکیبات آروماتیک سیر نشده می باشند.
نفت
پس ازجداکردن نمک ها، اسید ها و آب، نفت خام را پالایش می کنند. برای این کار از تقطیر جزء به جزء استفاده می شود. طی آن نفت خام را درون محفظه ای بزرگ گرما می دهند و آن را به برج تقطیر هدایت می کنند. درون برج تقطیر دما از پایین به بالا کاهش می یابد. بنابراین هنگامی که نفت خام داغ وارد قسمت پایین برج می شود، مولکول های سبک تر و فراتر (مانند مواد پتروشیمیایی) از مایع بیرون آمده و به سوی بالای برج حرکت می کنند. به تدریچ که این مولکول ها بالاتر می روند سرد شده و به مایع تبدیل می شوند و در سینی هایی که در فاصله های گوناگون برج قرار دارند وارد شده و از برج خارج می شوند. بنابراین محفظه هایی با نقطه جوش نزدیک به هم از نفت خام جداسازی می شوند که این مخلوط ها عبارت است از بنزین و خوراک پتروشیمیایی، نفت سفید، گازوییل، نفت کوره و ...
مقایسه اندازه مولکول ها: نفت کوره > گازوییل > نفت سفید > بنزین و خوراک پتروشیمی
تست 4:

دوستان عزیز می توانید برای دسترسی به نسخه کامل خلاصه نکات به همراه پاسخ فایل پی دی اف زیر را دانلود کنید!
فراموش نکنید اگر سوالی در رابطه با این مبحث داشتید می توانید به راحتی در کامنت ها سوال خود را برای ما بنویسید.
دوستان عزیزم؛ برای ارتباط با رتبه برترها صفحه اینستاگرام زیر رو دنبال کنید.
با آرزوی موفقیت و کامیابی




