سلام دوستان عزیز
در این مطلب می خواهیم نکته ها و حفظیات صفحات 1 تا 19 شیمی دهم مطابق با بودجه بندی آزمون 3 دی که برای پاسخگویی به سوالات آزمون باید به آنها مسلط باشید، بپردازیم.
 | دانشجوی مهندسی عمران دانشگاه تهران رتبه 328 منطقه دو - کنکور ریاضی 1398 |
بودجه بندی فصل اول در کنکور سال های اخیر
عنصر های سازنده ی سیاره ها
دو فضا پیمای 1 و 2 در سال 1977 میلادی برای شناخت بیشتر سامانه خورشیدی به فضا فرستاده شدند، وظایف این دو فضا پیما تهیه ی شناسنامه ی فیزیکی و شیمیایی از سیاره ی مشتری، زحل، اورانوس و نپتون که حاوی اطلاعاتی نظیر:
1- نوع عنصر سازنده 2- ترکیب شیمیایی در اتمسفر آنها 3- ترکیب درصد این مواد
مقایسه عناصر موجود در سیاره های مشتری و زمین
نظریه ی مهبانگ
درون ستاره ها
ستاره ها کارخانه ی تولید عناصر هستند. چون دمای درون ستاره ها بسیار بالا است.
نکته: هر چه دمای درون ستاره ها بیش تر باشد، شرایط برای تشکیل عناصر سنگین تر بیشتر است.
بر اثر واکنش های هسته ای انرژی آزادی می شود که از رابطه ی اینشتین E = mc^2 به دست می آید.
در این رابطه، m جرم ماده (Kg) و c سرعت نور 8^10 × 3 متر بر ثانیه است و E بر حسب ژول می باشد.
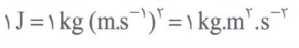
ذره های زیر اتمی، ایزوتوپ
به طور کلی ذره های سازنده ی هر اتم، زیر اتمی نامیده می شوند که مهم ترین آن ها عبارت است از: الکترون، پروتون و نوترون.
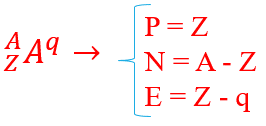
عدد اتمی نشان دهنده ی تعداد پروتون های هسته اتم است که با حرف z نشان داده می شود.
عدد جرمی، نشان دهنده مجموع تعداد پروتون ها و نوترون های هسته اتم است که با حرف A نشان داده می شود.
فرمول سریع


برای به دست آوردن تعداد پروتونها و نوترونها در گونه های چند اتمی، کافی است تعداد پروتونها و نوترونهای هر یک از اتمها را با هم جمع کنیم. برای محاسبه تعداد الکترونها در این گونه ها، اگر گونه موردنظر خنثی بود (مثل(H2O)، تعداد الکترون ها با تعداد پروتون ها برابر خواهد بود، اما اگر گونه چنداتمی، یون نبودند! با توجه به مثبت یا منفی بودن بار آن، به تعداد بار از تعداد پروتون ها کم (برای یونهای مثبت) و یا اضافه برای یون های منفی می شود تا تعداد الکترونها به دست آید.

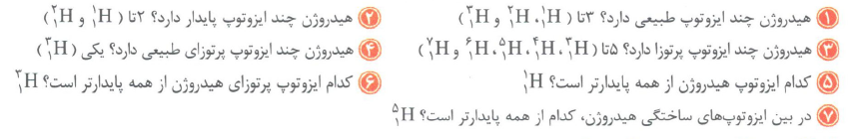
ایزوتوپ (هم مکان): به اتم هایی از یک عنصر، که دارای عدد اتمی یکسان و عدد جرمی متفاوتی هستند، گفته می شود.
نکته: ایزوتوپ ها خواص شیمیایی یکسانی دارند ولی برخی خواص فیزیکی وابسته به جرم آن ها مانند چگالی متفاوت است.

نکات

در میان 118 عنصر شناسایی شده، فقط 92 عنصر در طبیعت پیدا می شود. بنابراین 26 عنصر ساختگی در جدول دوره ای وجود دارند که به واسطه ی واکنش های هسته ای در راکتور ها ساخته می شوند.
تکنسیم Tc 99 - 43 اولین عنصر ساخته شده توسط دانشمندان بود که برای تصویربرداری غده ی تیروئید استفاده می شود و چون اندازه ی غده ی تیروئید با یون یدید مشابه است و غده ی تیروئید علاوه بر یون یدید، یون دارای(Tc) را نیز جذب می کند.
ایزوتوپ 235 U که فراوانی آن در مخلوط طبیعی کم تر از 0/7% است بعد از فرآیند غنی سازی ایزوتوپی به عنوان سوخت در راکتور های اتمی به کار می رود.
جدول دوره ای عنصر ها
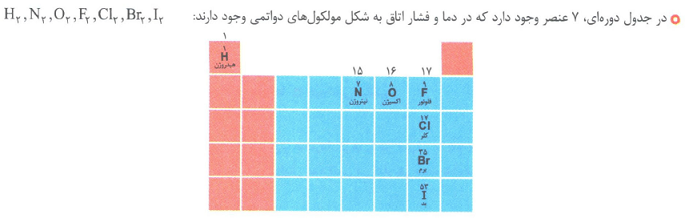
جدول تناوبی دارای 7 دوره(تناوب) و 18 گروه است.
خواص شیمیایی عنصر هایی که در یک گروه قرار دارد مشابه و خواص عناصر هم دوره متفاوت است. به عنوان مثال هلیم و آرگون متعلق به گروه 18 هستند، تمایل به انجام واکنش ندارند.
با پیمایش هر دوره از چپ به راست، خواص عنصر ها به طور تناوبی و مشابه هم تکرار می شود.
در این جدول، دوره ی اول با 2 عنصر کوتاه ترین و دوره ی6 و 7 با 32 عنصر بلند ترین دوره های جدول دوره ای هستند.
عناصر گروه 18 (گاز های نجیب) تمایلی به انجام واکنش شیمیایی ندارند. یا واکنش پذیری کمی دارند، مثل He, Ar
عناصر گروه 17 (هالوژن ها) یون پایدار( X- ) را تشکیل می دهند، مانندF, Cl, Br
جرم اتمی عنصر ها
دانشمندان برای اندازه گیری جرم اتم ها، از یکای جرم اتمی(amu) استفاده می کنند. جرم هر (amu) معادل 1/12 جرم ایزوتوپ ، «کربن-12» است.
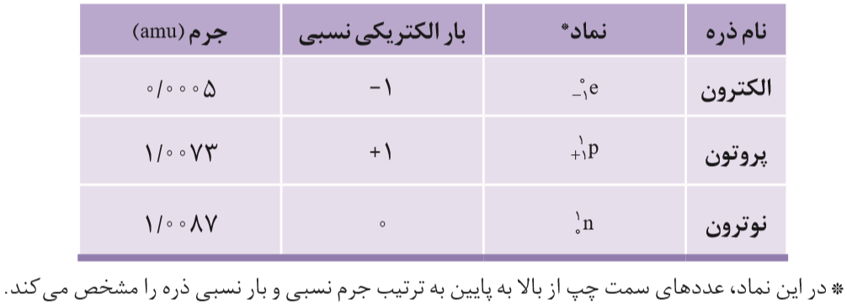
نکته: با توجه به اینکه جرم نسبی پروتون و نوترون حدود amu 1 است می توان گفت، جرم نسبی یک اتم تقریبا معادل با عدد جرمی آن است.
ایستگاه محاسبات:
برای محاسبه ی جرم اتمی میانگین از فرمول زیر استفاده می کنیم:
جرم های ایزوتوپ های عنصر: a1 , a2 , a3 فراوانی ایزوتوپ های عنصر: F1 , F2 , F3
شمارش ذره ها از روی جرم آن ها و مفهوم مول
اتم ها بسیار ریز هستند، به طوری که نمی توان با هیچ دستگاهی با شمارش تک تک آن ها، تعداد آن ها را به دست آورد، اما از روی جرم مواد می توان تعداد ذره های سازنده را شمارش کرد.
•دانشمندان با استفاده از دستگاهی به نام طیف سنج جرمی، جرم اتم ها را با دقت زیاد اندازه گیری می کنند.
•گرم، رایج ترین یکای اندازه گیری جرم در آزمایشگاه شناخته می شود؛ این در حالی است که یکای جرم اتمی (amu)، یکای بسیار کوچکی برای جرم به شمار می آید و کار با آن در آزمایشگاه(در عمل غیر ممکنه)! بین گرم و amu رابطه های زیر برقرار است:
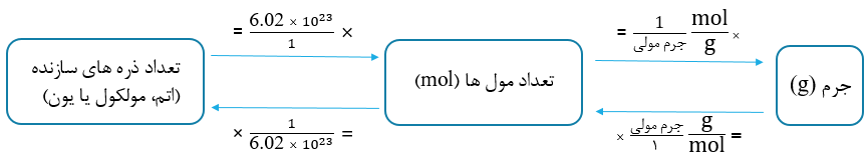
•برای اینکه بتوان جرم اتم ها را بر حسب گرم بیان کرد، دانشمندان«مول» را معرفی کردند. شیمی دان ها به تعداد 1023 × 6.02 از هر ذره (اتم، مولکول یا یون) یک مول از آن ذره می گویند و آن را با mol نشان می دهند.
•به افتخار شیمی دان ایتالیایی، آمدئو آووگادرو، یه عدد 1023 × 6.02، عدد آووگادرو گفته می شود و آن را با NA نشان می دهند.
نکته: عدد آووگادرو معکوس جرم یک amu بر حسب گرم است:
مسائل مول
•دیدیم که هر مول ذره برابر با 23^10 × 6.02 ذره می باشد. از طرفی جرم مولی یک ماده برابر با جرم یک مول ماده بر حسب گرم است؛ بنابراین می توان از عدد آووگادرو برای تبدیل مول به تعداد ذره ها (ویا برعکس) و از جرم مولی برای تبدیل تعداد مول به جرم (و یا برعکس) استفاده کرد. در طرح زیر، کسر تبدیل مربوط به هر یک از موارد آورده شده است.
تست ها
تست 1:
کدام موارد از مطالب زیر، نادرست اند؟
آ) پس ا زمهبانگ، با گذشت زمان و افزایش دما، گازهای تولید شده متراکم شدند و سحابی ها را ایجاد کردند.
ب) ستاره ها پس از تولد و رشد، زمانی می میرند و مرگ آن ها سبب می شود عنصرهای تشکیل دهندهء آن ها در فضا پراکنده شوند.
پ) عنصرهای اکسیژن و هیدروژن، جزء 8 عنصر اصلی سازنده در هر دو سیارهء زمین و مشتری هستند.
ت) با انجام واکنش های هسته ای درون ستاره ها، عنصرهای سبک تر به عنصرهای سنگین تر تبدیل می شوند.
1) آ و پ 2) ب و ت 3) آ و ت 4) ب و پ
تست 2:
اگر یون +A2 دارای 121 نوترون و 78 الکترون و یون B-3 دارای 41 نوترون و 36 الکترون باشد، تفاوت عدد اتمی و تفاوت عدد جرمی دو عنصر A و B به ترتیب از راست به چپ، کدام است؟
1) 47 – 126 2) 43 – 126 3) 47 – 127 4) 43 – 127
تست 3:
تعداد اتم های موجود در 14.2 گرم گاز کلر، دو برابر تعداد اتم ها موجود در 11.2 گرم عنصر تک اتمی A است. جرم مولی عنصر A کدام می باشد؟ (Cl = 35.5 g.mol-1)
1) 64 2) 56 3) 48 4) 32
دوستان عزیز می توانید برای دسترسی به نسخه کامل خلاصه نکات به همراه پاسخ فایل، پی دی اف زیر را دانلود کنید!
فراموش نکنید اگر سوالی در رابطه با این مبحث داشتید می توانید به راحتی در کامنت ها سوال خود را برای ما بنویسید.
برای ارتباط با رتبه برترها صفحه اینستاگرام زیر رو دنبال کنید.
با آرزوی موفقیت و کامیابی


