سلام دوستان عزیز
در این مطلب میخواهیم نکته ها و حفظیات صفحات 82 تا 107 شیمی دهم مطابق با بودجه بندی آزمون 5 آذر که برای پاسخگویی به سوالات آزمون باید به آنها مسلط باشید، بپردازیم.
| دانشجوی مهندسی عمران دانشگاه تهران رتبه 328 منطقه دو - کنکور ریاضی 1398 |
بودجه بندی فصل سوم در کنکور سال های اخیر
شناسایی یون ها
دریاها مخلوطی همگن از انواع یونها و مولکولها در آب هستند. از آنجایی که آبهایی که به دریاها میریزند، در مسیر خود از زمین هایی رد می شوند که مواد شیمیایی گوناگونی دارند، نوع و مقدار مواد حل شده در دریاها با یکدیگر تفاوت دارد. آب آشامیدنی هم علیرغم ظاهر زلال و شفافی که دارد، مانند آب دریاها ناخالص بوده و مخلوطی همگن حاوی مقدار کمی از یون های گوناگون مانند 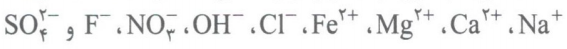 است. برخی از یون ها به طور طبیعی در آب حل شده اند و برخی دیگر مانند یون فلوئورید، در مراکز تأمین آب آشامیدنی سالم، به آب افزوده می شوند. وجود مقدار بسیار کم یون فلوئورید در آب آشامیدنی باعث حفظ سلامت دندان ها می شود و آب باران در هوای پاک تقریبا خالص است؛ زیرا هنگام تشکیل برف و باران، تقریبا همه مواد حل شده در آب، از آن جدا می شوند. این فرایند الگویی برای تهیه آب خالص است که به آن فرایند «تقطیر» و فراورده حاصل از آن را «آب مقطر» می گویند. و یکی از روش های شناسایی یون ها در آب یا محلول حاوی این یون ها، اضافه کردن محلول یک ترکیب یونی دیگر به آنهاست؛ به طوری که با یون موردنظر ما رسوب (ماده نامحلول) تشکیل دهد.
است. برخی از یون ها به طور طبیعی در آب حل شده اند و برخی دیگر مانند یون فلوئورید، در مراکز تأمین آب آشامیدنی سالم، به آب افزوده می شوند. وجود مقدار بسیار کم یون فلوئورید در آب آشامیدنی باعث حفظ سلامت دندان ها می شود و آب باران در هوای پاک تقریبا خالص است؛ زیرا هنگام تشکیل برف و باران، تقریبا همه مواد حل شده در آب، از آن جدا می شوند. این فرایند الگویی برای تهیه آب خالص است که به آن فرایند «تقطیر» و فراورده حاصل از آن را «آب مقطر» می گویند. و یکی از روش های شناسایی یون ها در آب یا محلول حاوی این یون ها، اضافه کردن محلول یک ترکیب یونی دیگر به آنهاست؛ به طوری که با یون موردنظر ما رسوب (ماده نامحلول) تشکیل دهد.
شناسایی یون ها
شناسایی یون Cl : اگر به محلول دارای این یون مانند سدیم کلرید، محلول دارای یون نقره مثل محلول نقره نیترات اضافه شود، در نهایت رسوب سفید رنگ نقره کلرید تشکیل خواهد شد:
شناسایی یون Ca : اگر به محلول دارای این یون مانند محلول کلسیم کلرید، محلول دارای یون فسفات مانند سدیم فسفات اضافه شود، رسوب سفید رنگ کلسیم فسفات تشکیل خواهد شد:
شناسایی یون Ba : اگر به محلول دارای این یون مانند محلول باریم کلرید، محلول دارای یون سولفات مانند سدیم سولفات اضافه شود، رسوب سفید رنگ باریم سولفات تشکیل خواهد شد:
یون های چند اتمی
به یون هایی که از دو یا چند اتم یکسان یا متفاوت تشکیل شده باشند، یون های چند اتمی می گویند؛ مانند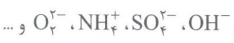
* در ساختار یون های چند اتمی، اتم ها با یکدیگر پیوند اشتراکی (کووالانسی) دارند. بار این یون ها به اتم خاصی تعلق ندارد بلکه متعلق به کل مجموعه است؛ به همین دلیل در واکنش ها به صورت یک واحد مستقل عمل می کنند.
محلول، مخلوطی همگن از دو یا چند ماده است که حالت فیزیکی و شیمیایی محلول در سرتاسر آن یکسان و یکنواخت است. برخی محلول ها مانند سرم فیزیولوژی رقیق و برخی مانند گلاب دو آتشه غلیظ است.
حلال، جزئی از محلول است که حل شونده را در خود حل میکند و شمار مول های آن بیشتر است. خواص محلول به خواص حلال، حل شونده و مقدار هر یک از آن ها بستگی دارد.
غلظت یک محلول برابر با مقدار حل شونده در مقدار معینی از حلال یا محلول تعریف می شود. برای بیان غلظت محلول های بسیار رقیق از کمیتی به نام قسمت در میلیون(ppm) استفاده می شود.
با افزودن مقداری حل شونده به یک محلول در حجم ثابت، غلظت محلول افزایش می یابد.
با افزودن مقداری حلال به محلولی با غلظت معین، غلظت محلول کاهش می یابد.
فلز منیزیم ماده ارزشمند دیگری است که در تهیه ی آلیاژها، شربت معده و .... استفاده می شود. یکی از منابع تهیه این فلز آب دریاست. منیزیم در آب دریا به شکل +Mg وجود دارد. برای استخراج و جداسازی آن، در مرحله نخست، منیزیم را به صورت ماده ی جامد و نامحلول Mg(OH)2 رسوب می دهند، سپس آن را به منیزیم کلرید تبدیل می کنند.
در پایان با استفاده از جریان برق، منیزیم کلرید را به عنصرهای سازنده ی آن تجزیه می کنند.
بیشترین مقدار یک ماده بر حسب گرم که در 100 گرم حلال در دمای معین حل می شود، انحلال پذیری آن ماده نامیده می شود.
مواد بر اساس انحلال پذیری در آب در دمای معین به سه دسته تقسیم می شوند:
1- مواد محلول: موادی هستند که انحلال پذیری آن ها در دمای معین بیش از 1 گرم در 100 گرم آب باشد. مانند شکر، سدیم نیترات، سدیم کلرید.
2- مواد نامحلول: موادی هستند که انحلال پذیری آن ها در دمای معین کم تر از 0/01 گرم در 100 گرم آب باشد. مانند کلسیم فسفات، نقره کلرید و باریم سولفات.
3- مواد کم محلول: موادی هستند که انحلال پذیری آن ها در دمای معین بین 0/01 تا 1 گرم در 100 گرم آب باشد. مانند کلسیم سولفات.
محلول سیر نشده: محلولی است که در یک دمای معین، می تواند مقدار بیشتری از ماده ی حل شونده را در خود حل کند، یعنی مقدار ماده ی حل شونده کمتر از مقدار انحلال پذیری آن ماده در همان دما است.
محلول سیر شده: محلولی است که در دمای معین، نمی تواند مقدار بیشتری از ماده ی حل شونده را در خود حل کند.
محلول فرا سیر شده: محلولی است که در دمای معین، مقدار حل شونده ی موجود در آن بیشتر از مقدار انحلال پذیری آن ماده در همان دما باشد. این محلول ناپایدار است و بر اثر ضربه، تغییر ناگهانی دما و یا اضافه کردن مقداری حل شونده، مقدار اضافی حل شونده در محلول به سرعت رسوب می کند.
ایستگاه محاسبات:
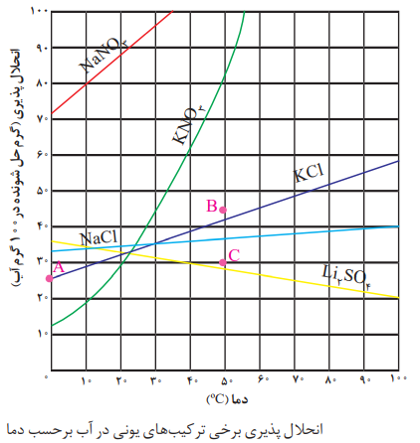
نکته: انحلال پذیری نمک ها به نوع آن ها و دما بستگی دارد، ولی تاثیر دما بر مقدار انحلال پذیری آن ها یکسان نیست. نموداری که اثر دما بر انحلال پذیری یک ماده را نشان می دهد، نمودار انحلال پذیری _ دما گویند.
نکته: در این نمودار، نقاط روی منحنی نشان دهنده محلول سیر شده، نقاط زیر منحنی نشان دهنده محلول سیر نشده و نقاط بالای منحنی نشان دهنده محلول فراسیر شده است.
نکته: به طور کلی هر چه شیب نمودار یک ماده بیشتر باشد، تاثیر دما بر انحلال پذیری آن بیشتر است. به عنوان مثال در نمودار روبرو انحلال پذیری KNO3 بیش تر از KCl است.
* در این قسمت با مسائلی سر و کار دارید که مبنای نمودار انحلال پذیری دما می باشد و در آن ها ممکن است مقدار جرم حل شونده، جرم حلال یا جرم رسوب ته نشین شده خواسته شود.
* برای حل این نوع مسائل از روی نمودار می توان انحلال پذیری را در هر دمایی به دست آورد و سپس با توجه به رابطه انحلال پذیری، مقدار حل شونده یا حلال را به دست آورد.
نکته: اگر در مسائلی جرم رسوب تولید شده ضمن کاهش دما (در نمودار های صعودی) و یا افزایش دما (در نمودار های نزولی) خواسته شود، می توان از کسرهای تناسبی زیر استفاده کرد.

نکته: معادله ی خطی که رابطه ی بین انحلال پذیری و دما را نشان می دهد به شرح زیر است: S=aθ+b
اثر دما بر انحلال پذیری مواد
یکی از عوامل مؤثر بر انحلال پذیری مواد در آب، دما است. با توجه به شکل روبه رو: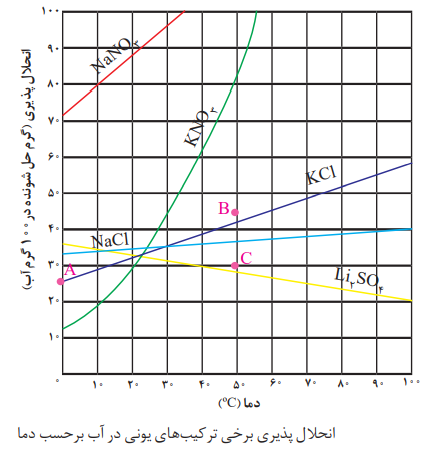
نمودار انحلال پذیری برخی مواد مانند KC1 ، KNO3 ، NaNO3 برحسب دما، صعودی است؛ یعنی با افزایش دما، انحلال پذیری آنها افزایش می یابد.
نمودار انحلال پذیری برخی مواد (مانندLiSO4) برحسب دما نزولی است؛ یعنی با افزایش دما، انحلال پذیری آنها کم می شود.
نمودار انحلال پذیری برخی مواد مانند NaCl برحسب دما به صورت خطی تقریبا افقی است؛ یعنی تغییر دما تأثیر چندانی بر انحلال پذیری آنها ندارد. و هر چه قدرمطلق شیب نمودار انحلال پذیری یک ماده بیشتر باشد، تأثیر دما بر انحلال پذیری آن ماده بیشتر است با توجه به نمودارهای رسم شده، تأثیر دما بر انحلال پذیری KNO3 از همه بیشتر و بر انحلال پذیری NaCl از همه کمتر است.
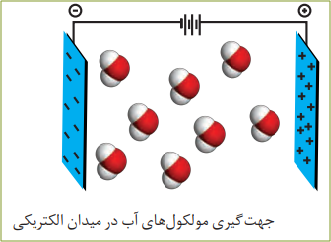
مولکول های قطبی:
نحوۀ جهت گیری مولکول های آب در میدان الکتریکی نشان میدهد که اتم اکسیژن، سرِ منفی و اتمهای هیدروژن، سرِ مثبت مولکول را تشکیل می دهند. شیمیدان ها به مولکول هایی مانند آب که در میدان الکتریکی جهت گیری می کنند، مولکول های دوقطبی یا قطبی می گویند.
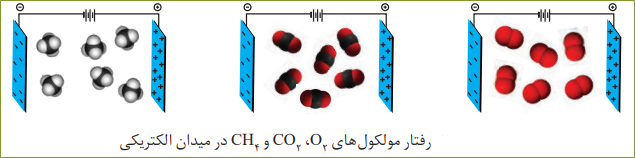
مولکول های ناقطبی:
مولکول های سازندۀ ترکیب هایی مانند گاز اکسیژن O2، کربن دی اکسید CO2 و متان CH4 در میدان الکتریکی جهت گیری نمی کنند چنین مولکول هایی، ناقطبی نامیده میشوند.
راه های تشخیص مولکول های قطبی و ناقطبی
1- مولکول های دو اتمی که اتم های سازنده آن ها متفاوت هستند، قطبی می باشند. مانند: HF, CO, HCl
2- مولکول های چند اتمی که در آن ها، اتم های اطراف اتم مرکزی متفاوت هستند، قطبی هستند. مانند: COCl2 , CH2O , HCN
3- مولکول های چند اتمی که در آن ها اتم مرکزی دارای الکترون ناپیوندی باشد، اغلب قطبی هستند. مانند: NH3 , SO2 , O3 و .........
انواع نیروهای بین مولکولی:
میان مولکول های سازنده ی یک ماده بر هم کنش هایی وجود دارد که موجب می شود یک ترکیب بتواند به یکی از 3 حالت گاز، مایع یا جامد در بیاید. به این نیرو ها و برهم کنش ها نیروی بین مولکولی گفته می شود.
نیرو های بین مولکولی عبارت اند از: 1- نیرو های واندروالسی 2- پیوند هیدروژنی
نیرو های واندروالسی به دو عامل بستگی دارد:
1- قطبیت مولکول ها 2- جرم مولی
نکته: به طور کلی هر چه نیرو های بین مولکولی در ترکیبی قوی تر باشد، ترکیب مورد نظر آسان تر از گاز به مایع تبدیل می شود.
ترکیب هایی که در ساختار خود پیوند (F-H O-H یا N-H) دارند، می توانند با مولکول های خود پیوند هیدرژنی تشکیل دهند؛ به طور مثال همان طور که دیدید، بین مولکول های آب پیوند هیدروژنی برقرار می شود.
توجه: به طور کلی اگر اتم هیدروژن (H) بین دو اتم از اتم های FON در دو مولکول باشد، آن پیوند، پیوند هیدروژنی است. به این ترتیب برخی از اتم ها در ساختار خود پیوند (F-H O-H یا N-H) ندارند، ولی می توانند با یک مولکول دیگر، پیوند هیدروژنی تشکیل دهند. به طور مثال استون نمی تواند با مولکول های خود پیوند هیدروژنی تشکیل دهد، اما با مولکول های آب می تواند.
پیوند هیدروژنی:
یکی از انواع نیرو های بین مولکولی است که بین مولکول های دارای اتم هیدروژن متصل به یکی از اتم های F, O, N ایجاد می شود.
تست 1:
کدام گزینه نادرست است؟
1) شمار اتم های اکسیژن در آلومینیم سولفات 2 برابر شمار این اتم ها در کلسیم نیترات است.
2) اگر فرمون شیمیایی کربنات فلز M از دستهء S جدول تناوبی به صورت MCO3 باشد، فرمول شیمیایی فسفات آن به صورت M3PO4 است.
3) مجموع شمار یون های سازندهء دو ترکیب آمونیم سولفات و کلسیم کلرید برابر است.
4) افزون بر یون ها تک اتمی منیزیم، آهن (II) و کلرید، یون های چند اتمی هیدروکسید و نیترات هم در آب آشامیدنی وجود دارند.
تست 2:
چند مول آب به 160 گرم محلول 40% جرمی کلسیم برمید اضافه کنیم تا محلول 32% جرمی آن به دست آید؟ (O=16 , H=1g:mol-1)
1) 2.22 2) 4 3) 4.44 4)6.2
تست 3:

دوستان عزیز می توانید برای دسترسی به نسخه کامل خلاصه نکات به همراه پاسخ فایل، پی دی اف زیر را دانلود کنید!
فراموش نکنید اگر سوالی در رابطه با این مبحث داشتید می توانید به راحتی در کامنت ها سوال خود را برای ما بنویسید.
برای ارتباط با رتبه برترها صفحه اینستاگرام زیر رو دنبال کنید.
با آرزوی موفقیت و کامیابی



