سلام دوستان عزیز
در این مطلب میخواهیم نکته ها و حفظیات فصل 2 دوازدهم مطابق با بودجه بندی آزمون 5 آذر که برای پاسخگویی به سوالات آزمون باید به آنها مسلط باشید، بپردازیم.
دانشجوی دکتری تخصصی پیوسته بیوتکنولوژی دانشگاه تهران رتبه 111 - کنکور ریاضی 1394 | |
 | دانشجوی پزشکی دانشگاه علوم پزشکی کاشان رتبه 800 منطقه 1 - کنکور تجربی 1400 |
• علم الکتروشیمی دارای دستاوری های زیادی بوده که از جملهی آنها میتوان به موارد روبرو اشاره کرد.
1 -تولید انرژی الکتریکی پاک و ارزان 2 -افزایش سطح رفاه و آسایش را در جهان 3 -تهیه مواد جدید 4 -پیاده کردن اصول شیمی سبز
• الکتروشیمی شاخهای از دانش شیمی است که در بهبود خواص مواد و تأمین انرژی نقش بسزایی دارد .
• پدیدههای طبیعی همچون تندر و آذرخش از ماهیت الکتریکی ماده سرچشمه می گیرند و شامل داد و ستد الکترون میشوند. در این پدیدهها، بخشی از(نه همه) انرژی آزاد شده در قالب انرژی الکتریکی مبادله می شود.
• اتاق باتری، سمعک، انتقال ایمن آب و قطار برقی، نمونههایی از فناوریی هایی هستند که نقش الکتروشیمی را در رفاه و آسایش نشان می دهند.
• دو رکن اساسی تحقق فناوری های وابسته به الکتروشیمی، موارد روبرو است: 1 -دستیابی به مواد مناسب 2 -تأمین انرژی
• پرکاربرد ترین شکل انرژی در به کارگیری فناوری های مختلف انرژی الکتریکی است.
• در جدول زیر به برخی قلمروهای الکتروشیمی می پردازیم:

• باتری یکی از فراورده های مهم صنعتی است که در محل مورد نیاز با انجام واکنشهای شیمیایی، الکتریسیته تولید می کند. برای نمونه تأمین انرژی الکتریکی برای تنظیم کننده ضربان قلب، سمعک، تلفن همراه، اندام مصنوعی، دوربین دیجیتال، رایانه قابل حمل و خودروی الکتریکی به باتری وابسته است. در ساختار باتری ها، بخشی از انرژی(نه همه) شیمیایی ذخیره شده در مواد در قالب انرژی الکتریکی آزاد می شود.
• ساخت لولههای فلزی انتقال آب، قوطیهای محتوی مواد غذایی، لوازم آشپزی که در برابر خوردگی مقاوم هستند و مانع از آلوده شدن آب و مواد غذایی می شوند، همچنین کسب اطمینان از کیفیت تولید فراورده های دارویی، بهداشتی و غذایی، چهرههای دیگری از استفادههای علم الکتروشیمی هستند.
• یکی از راه های بهرهگیری از انرژی ذخیره شده در فلزها، اتصال آن ها در شرایط مناسب به یکدیگر است. برای نمونه با یک تیغه مسی و تیغهای دیگر مانند روی و با میوهای مانند لیمو میتوان نوعی باتری ساخت و با آن یک لامپ LED را روشن کرد که در آن روی نقش آند و مس نقش کاتد را ایفا می کند. ساختار این باتری ها به صورت زیر است:
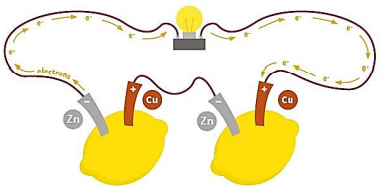
• چراغ خورشیدی یک ابزار روشنایی است که با استفاده از لامپ LED ،سلول خورشیدی(نوعی مولد که در ساختار آن سیلیسیم وجود داشته و با استفاده از نور خورشید، انرژی الکتریکی تولید می کند) و باتری قابل شارژ تشکیل شده است.
• باتری، مولدی است که در آن واکنشهای شیمیایی رخ میدهد تا بخشی از(نه همه) انرژی شیمیایی مواد به انرژی الکتریکی تبدیل شود. انرژی حاصل از این فرایند، می تواند یک موتور الکتریکی را به حرکت در بیاورد.
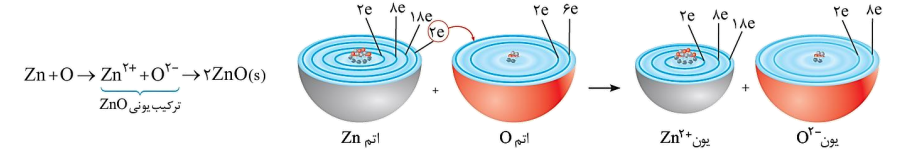
• اکسیژن نافلزی فعال است که با اغلب(نه همه) فلزها واکنش میدهد و آنها را به اکسید فلز تبدیل می کند، در حالیکه با برخی فلزها مانند طلا و پلاتین الکتروشیمی واکنش نمیدهد . اتم اکسیژن حین واکنش با فلزات 2 عدد الکترون از فلز گرفته و به لایه آخر خود اضافه می کند و به آرایش پایدار می رسد.
• روی، از جمله فلزهایی است که با اکسیژن واکنش میدهد. تصویر زیر نمایی از این واکنش را نشان می دهد:
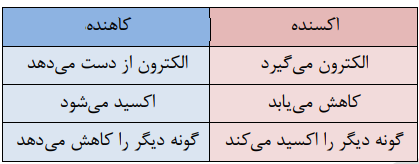
• در واکنش های الکتروشیمیایی، گرفتن الکترون را کاهش و از دست دادن الکترون را اکسایش می نامیم. در این شرایط، گونهای که الکترون از دست می دهد را کاهنده و گونهای که الکترون دریافت می کند را اکسنده می نامیم. آند الکترودی است که در آن نیم واکنش اکسایش انجام شده و کاتد الکترودی است که در آن نیم واکنش کاهش رخ میدهد.
در جدول زیر به خلاصهی مطالب بالا میپردازیم:
• شیمی دانها هریک از فرایندهای گرفتن و از دست دادن الکترون را با یک نیمواکنش نمایش میدهند که هر نیم واکنش باید از لحاظ جرم(تعداد اتم ها) و بار الکتریکی موازنه باشد.
• اغلب(نه همه) فلزها در واکنش با نافلزها تمایل دارند یک یا چند الکترون خود را به نافلزها داده و ضمن اکسایش به کاتیون تبدیل شوند. نافلزها نیز با گرفتن یک یا چند الکترون کاهش یافته و به آنیون تبدیل میشوند. از این رو فلزها اغلب(نه همواره) کاهنده و نافلزها اغلب(نه همواره) اکسنده هستند.
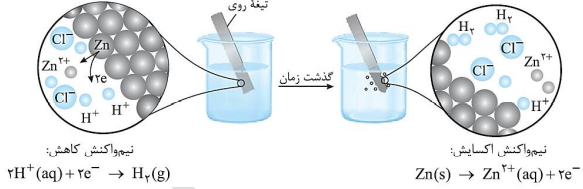
• اغلب(نه همه) فلزها در واکنش با محلول اسیدها، گاز هیدروژن و نمک تولید می کنند. تصویر زیر، نمایی از این واکنش را نشان می دهد:
• می دانیم که همهی واکنشها با مبادله انرژی همراه هستند. در برخی واکنشهای اکسایش-کاهش افزون بر داد و ستد الکترون، انرژی نیز آزاد می شود. به عنوان مثال، فلزهایی مانند منیزیم و سدیم در اکسیژن می سوزند، نور و گرما تولید میکنند.
• در گذشته برای عکاسی از فرایند سوختن منیزیم به عنوان منبع نور استفاده میشده است. در این واکنش، فلز منیزیم با نور خیره کنندهای در O2(g) میسوزد و به منیزیم اکسید تبدیل می شود. در واکنش مورد نظر، منیزیم کاهنده و اکسیژن اکسنده است.
•تمایل فلزها برای از دست دادن الکترون در محلول های آبی یکسان نیست . به دیگر سخن فلزها قدرت کاهندگی متفاوتی دارند. برای نمونه فلز روی کاهنده تر از مس است. در واکنشهایی از این دست که خود به خود انجام میشوند، مخلوط واکنش گرمتر میشود زیرا سامانۀ واکنش بخشی از( نه همه) انرژی خود را به شکل گرما به محیط می دهد. به عنوان مثال، واکنش میان محلول مس(II) سولفات با فلز روی به صورت زیر است:
دوستان عزیز می توانید برای دسترسی به نسخه کامل خلاصه نکات به همراه پاسخ فایل، پی دی اف زیر را دانلود کنید!
فراموش نکنید اگر سوالی در رابطه با این مبحث داشتید می توانید به راحتی در کامنت ها سوال خود را برای ما بنویسید.
برای ارتباط با رتبه برترها صفحه اینستاگرام زیر رو دنبال کنید.
با آرزوی موفقیت و کامیابی


