سلام دوستان عزیز
در این مطلب می خواهیم نکته ها و حفظیات فصل 1 دوازدهم مطابق با بودجه بندی آزمون 7 آبان صفحهء 17 تا 28 که برای پاسخگویی به سوالات آزمون باید به آنها مسلط باشید، بپردازیم.
 | دانشجوی مهندسی عمران دانشگاه تهران رتبه 328 منطقه 2 - کنکور ریاضی 1398 |
 | محمد حسین خیری دانشجوی پزشکی کاشان رتبه 800 منطقه 1 - کنکور تجربی 1400 |
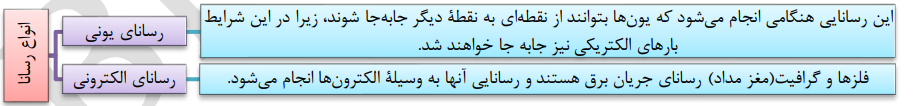
مواد رسانا را به دو دسته زیر تقسیم می کنیم:
•میزان رسانایی محلول های آبی به مجموع غلظت مولی یونهای موجود در آنها بستگی دارد. با افزایش مجموع غلظت یونهای موجود در یک محلول، رسانایی محلول بیشتر می شود.
• هرگاه محلول سدیم کلرید در مدار الکتریکی قرارگیرد، جریان برق در مدار برقرار می شود، زیرا یونها به سوی قطبهای ناهمنام حرکت میکنند. طی این فرایند، یون هاییک بار مثبت سدیم به سوی قطب منفی و یون هاییک بار منفی کلر به سوی قطب مثبت پیش میروند. جابه جایی یون ها نشان دهند جابهجایی بارهای الکتریکی و در نتیجه، رسانایی الکتریکی محلول سدیم کلرید است.
• به موادی مانند NaCl، الکترولیت و به محلول حاصل از این مواد، محلول الکترولیت می گویند.
• به موادی مانند اتانول و شکر که انحالل آنها در آب به شکل مولکولی است، غیرالکترولیت و به محلول آنها، محلول غیر الکترولیت می گویند. این محلولها جریان الکتریسیته را از خود عبور نمی دهند.
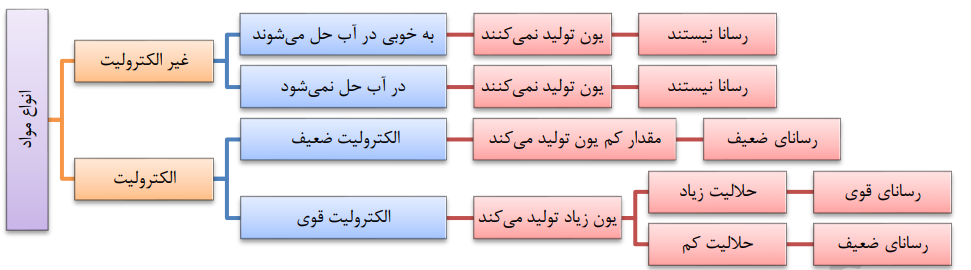
• در نمودار زیر، رفتار انواع مواد و محلول ها در برابر جریان الکتریسیته مقایسه شده است:
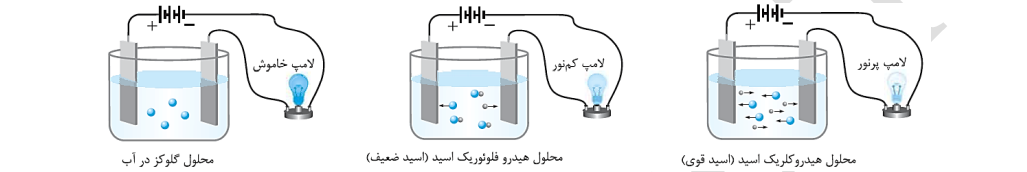
تصویر زیر، رفتار سه محلول مختلف را در مسیر جریان الکتریسیته نشان میدهد:
به فرایندی که در آن یک ترکیب مولکولی در آب به یونهای مثبت و منفی تبدیل می شود، یونش میگویند. توجه داریم که اصطلاح یونش، فقط مختص به ترکیبهای مولکولی است.
• به اسیدی که هر مولکول آن در آب تنها می تواند یک یون هیدرونیوم تولید کند، اسید تک پروتوندار می گویند.
• اسیدها را بر اساس میزان درجه یونش آنها میتوان به دو تقسیم بندی کرد. دسته اول اسیدهای قوی هستند که میتوان یونش آنها را در آب کامل در نظر گرفت1 ≅ a) ) و دستهی دوم، اسیدهای ضعیف هستند که در آب به میزان جزئی یونیده میشوند. در این رابطه، داریم:
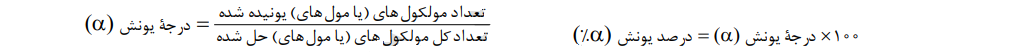
• اسیدهای قوی را می توان محلولی شامل یونهای آب پوشیده دانست، به طوری که در آنها تقریباً مولکولهای یونیده نشده یافت نمیشود. این در حالی است که در محلول اسیدهای ضعیف، افزون بر اندک یونهای آب پوشیده، مولکولهای اسید نیز یافت میشوند.
• نمودارهای زیر، شرایط مربوط به انواع اسیدها و بازهای قوی و ضعیف را نشان می دهد:
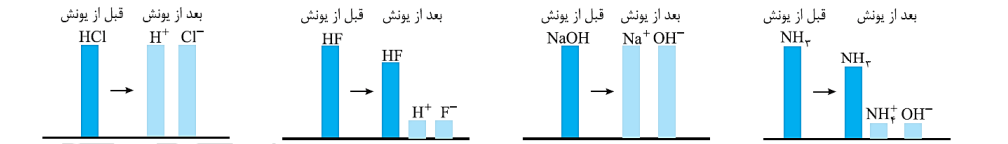
• کربوکسیلیک اسیدها از جمله اسیدهای ضعیف هستند که فقط هیدروژن گروه کربوکسیل آنها می تواند به صورت یون هیدرونیوم وارد محلول شود. به عنوان مثال، در محلول سرکه، شمار ناچیزی از یونهای آب پوشیده همزمان با شمار زیادی از مولکول های استیکاسید یونیده نشده حضور دارند. اسید های موجود در سیب، انگور، ریواس و مرکبات مانند پرتقال و لیمو نیز از جمله اسیدهای خوراکی و ضعیف هستند.
• واکنش برگشتپذیر، واکنشی است که در شرایط مناسب، هم زمان در هر دو جهت رفت و برگشت انجام می شود تا اینکه سرانجام لحظهای فرا می رسد که غلظت واکنش دهندهها و فراوردهها در آن ثابت می ماند. این ویژگی تنها هنگامی رخ می دهد که سرعت واکنش رفت با برگشت برابر شود. در این شرایط، هر مقداری از فراورده ها که در واحد زمان تولید می شود، هم زمان به همان مقدار از آنها نیز مصرف میشود.
• حضور هم زمان واکنش دهندهها و فراوردهها در مخلوط واکنش را می توان نشانهای از برگشت پذیر بودن واکنش ها دانست. در شیمی به چنین سامانههایی، سامانه تعادلی میگویند. واکنشهای رفت و برگشت در سامانههای تعادلی به طور پیوسته و با سرعت برابر انجام میشوند و به همین دلیل، مقدار مواد شرکتکننده در سامانه ثابت می ماند.
• نمونهای از سامانههای تعادلی، محلول بازها و یا اسیدهای ضعیف در آب است. در این محلولها به دلیل یونش ناچیز مولکولهای بازی یا اسیدی، میان اندک یونهای حاصل از یونش و مولکولهای یونیده نشده، تعادل برقرار می شود. برای نمونه در محلول هیدروفلوئوریک اسید تعادل زیر برقرار است.
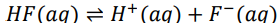
• سامانههای تعادلی را از دیدگاه کمّی نیز میتوان بررسی کرد به طوری که این سامانه ها با کمیتی به نام ثابت تعادل(K) توصیف میشوند. با قراردادن غلظت تعادلی گونههای شرکتکننده در واکنش یونش اسیدهای ضعیف در رابطه ثابت تعادل، مقدار K برای این واکنش به صورت زیر به دست میآید:
در جدول زیر، محدوده ی pH بعضی از قسمت های بدن را مشاهده می کنیم:


تست 1:

تست2:
دوستان عزیز می توانید برای دسترسی به نسخه کامل خلاصه نکات به همراه پاسخ فایل، پی دی اف زیر را دانلود کنید!
فراموش نکنید اگر سوالی در رابطه با این مبحث داشتید می توانید به راحتی در کامنت ها سوال خود را برای ما بنویسید.
با آرزوی موفقیت و کامیابی


