سلام
در این مطلب می خواهیم با هم به جمع بندی نکات شیمی 3 از صفحه ی 26 تا 36 (مطابق با آزمون) و خلاصه نکات که برای پاسخگویی به سوالات آزمون باید به آنها مسلط باشید، بپردازیم.
نوید آرمات، دانشجوی مهندسی عمران دانشگاه تهران
برای دسترسی به قسمت اول مبحث اسید و باز به لینک زیر مراجعه کنید:
اسید و باز(1)-شیمی دوازدهم-خلاصه نکات+نمونه سوال - نوید آرمات
نکته: در اسید های تک پروتون دار قوی (HNO3, HCl, HBr, HI) غلظت یون هیدرونیوم برابر غلظت اسید است.
نکته: در محلول بازهای یک ظرفیتی (هیدروکسید فلزهای قلیایی شامل (CsOH, RbOH, KOH, NaO, LiOH) غلظت OH- برابر مولاریته ی باز است.
نکته: در محلول بازهای قوی دو ظرفیتی ( هیدروکسیدهای کلسیم، استرانسیم و باریم یعنیCa(OH)2 , Sr(OH)2 Ba(OH)2 غلظت یون هیدروکسید 2 برابر غلظت باز است.
نکته: در مسائل مربوط به خنثی سازی اسید و باز از رابطه ی زیر استفاده می کنیم: n1M1V1= n2M2V2
نکته: محاسبه غلظت مخلوط حاصل از دو محلول:
نکته: اگر مسیر یک لوله با اسید چرب مسدود شده باشد، میتوان با اضافه کردن محلول غلیظ سدیم هیدروکسید، اسید چرب را به نمک سدیم آن(صابون جامد) که محلول در آب است تبدیل کرد، در نتیجه لوله باز می شود.
نکته: برای باز کردن لوله هایی که CaCO3 در آن ها رسوب کرده از HCl استفاده می شود.
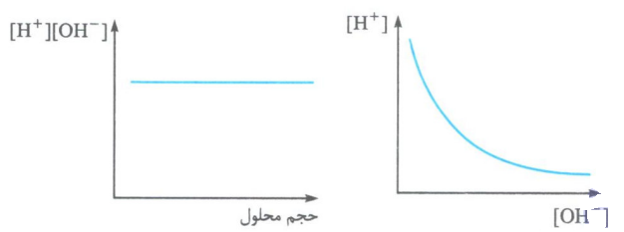 تغییر غلظت یون های هیدرونیوم و هیدروکسید در محلول های آبی و دمای اتاق را می توان به صورت روبه رو نشان داد:
تغییر غلظت یون های هیدرونیوم و هیدروکسید در محلول های آبی و دمای اتاق را می توان به صورت روبه رو نشان داد:
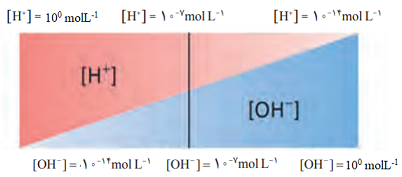
در محلول های اسیدی هم، یون هیدروکسید وجود دارد، فقط غلظت آن از یون هیدرونیوم کم تر است. به همین ترتیب در محلول های بازی هم، یون هیدرونیوم وجود دارد و فقط غلظت آن از یون هیدروکسید کم تر است. به طور خلاصه در دمای اتاق می توان نوشت:

بازها هم مانند اسیدها به دو دستهء قوی و ضعیف تقسیم می شوند. سود سوزآور(NaOH) و پتاس سوزآور (KOH) از جمله بازهای قوی هستند به طوری که موادی خورنده به شمار می روند. از محلول این بازها می توان به عنوان لوله بازکن استفاده کرد.
آمونیاک (NH3) از جمله بازهای ضعیف است و در آب به طور جزئی یونیده می شود؛ به طوری که در محلول آن علاوه بر مقدار کمی از یون های آبپوشیده، شمار بسیاری از مولکول های آمونیاک نیز یافت می شود.
 از محلول آمونیاک به عنوان شیشه پاک کن استفاده می شود.
از محلول آمونیاک به عنوان شیشه پاک کن استفاده می شود.
واکنش اسید – باز و عملکرد شوینده های خورنده
اسید و بازها می توانند با هم واکنش داده و یکدیگر را خنثی کنند. به طور مثال واکنش بین محلول هیدرولیک اسید با سدیم هیدروکسید به صورت روبه رو است:
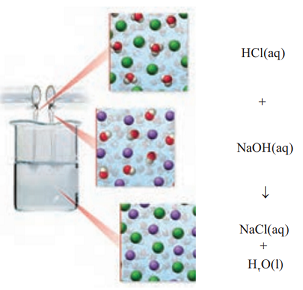
همان طور که می بینید در این واکنش، یون های هیدرونیوم در واکنش با یون های هیدروکسید به مولکول های آب تبدیل می شوند. در حالی که یون های Na+(aq) و Cl-(aq) دست نخورده باقی می مانند؛ بنابراین می توان واکنش اسید – باز در محلول های آبی را به صورت زیر نشان داد:
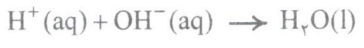 توجه: واکنش اسید – باز با تولید نمک و آب همراه است. طی این واکنش فلز موجود در این باز با هیدروژن موجود در اسید جابه جا می شود:
توجه: واکنش اسید – باز با تولید نمک و آب همراه است. طی این واکنش فلز موجود در این باز با هیدروژن موجود در اسید جابه جا می شود:
 واکنش خنثی شدن اسید – باز، مبنایی برای کاربرد برخی از شوینده ها و پاک کننده ها است. به طور مثال اگر یک اسید چرب، مسیر لوله را مسدود کرده باشد و ما محلول سدیم هیدروکسید را در لوله بریزیم، طی یک واکنش اسید – باز، صابون تولید می شود و می تواند چربی ها در آب پخش کند.
واکنش خنثی شدن اسید – باز، مبنایی برای کاربرد برخی از شوینده ها و پاک کننده ها است. به طور مثال اگر یک اسید چرب، مسیر لوله را مسدود کرده باشد و ما محلول سدیم هیدروکسید را در لوله بریزیم، طی یک واکنش اسید – باز، صابون تولید می شود و می تواند چربی ها در آب پخش کند.
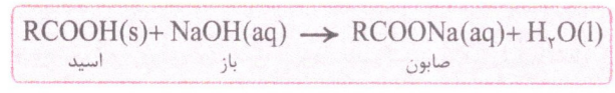
در این واکنش، کاتیون سدیم در باز با هیدروژن گروه عاملی کربوکسیل در اسید جا به جا شده و ضمن تولید صابون، آب هم تولید می شود.
برای بازکردن برخی لوله ها و مجاری از محلول غلیظ هیدروکلریک اسید استفاده می شود. موادی که سبب گرفتگی این لوله ها و مجاری می شوند، خاصیت بازی دارند، به طوری که روی دیوارهء لوله ها و مجاری به شکل رسوب به جای مانده اند. بد نیست بدانید که یکی از این مواد، کلسیم کربنات است.
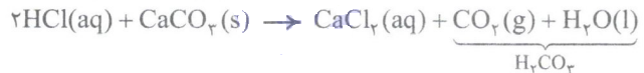 همان طور که می بینید در این واکنش علاوه بر یک فرآوردهء محلول در آب، گاز CO2 هم تولید می شود که می تواند با ایجاد فشار و ضربه زدن به رسوب ها، آن ها را از بین می برد.
همان طور که می بینید در این واکنش علاوه بر یک فرآوردهء محلول در آب، گاز CO2 هم تولید می شود که می تواند با ایجاد فشار و ضربه زدن به رسوب ها، آن ها را از بین می برد.
شیرهء معده و ضد اسیدها
معده برای گوارش غذا به اسید نیاز دارد. خوردن غدا باعث می شود که غده های موجود در دیوارهء معده، هیدروکلریک اسید (HCl) ترشح کنند.
در بدن انسان بالغ روزانه بین 2 تا 3 لیتر شیرهء معده، تولید می شود که غلظت یون هیدرونیوم در آن در حدود mol.L-1 0/03 است؛ یعنی pH شیرهء معده حدود 1.5 می باشد.
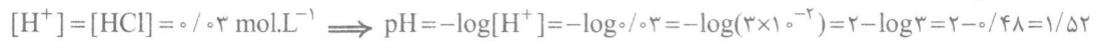
درون معده یک محیط بسیار اسیدی است، به طوری که می تواند فلز روی (Zn) را در خود حل کند.

دیوارهء داخلی معده هم به طور طبیعی مقدار کمی از یون های هیدرونیوم را جذب می کند که متاسفانه با عث نابودی سلول های سازندهء دیوارهء معده می شود. حالا اگر مقدار اسید معده به هر دلیل بیش از اندازه باشد، شمار یون های H+ جذب شده توسط سلول های دیوارهء معده افزایش یافته و باعث درد، التهاب و گاهی خونریزی معده می شود.
یکی از راه های درمان و کاهش درد معده، استفاده از ضداسیدها است. این مواد خاصیت بازی دارند و می توانند با اسید معده واکنش داده و آن را خنثی کنند. به طور مثال شیر منیزی یک از رابج ترین ضداسیدها است که شامل منیزیم اسید می باشد:
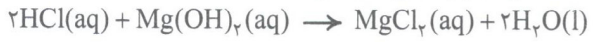
همان طور که می بینید یک مول مینزیم هیدروکسید، 2 مول اسید معده را خنثی می کند.
در جدول زیر برخی دیگر از مواد موثر موجود در ضداسیدها آورده شده است:
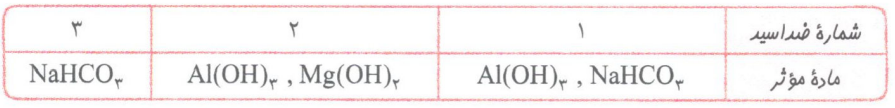
نام ماده NaHCO3، سدیم هیدروژن کربنات یا همان جوش شیرین است. واکنش این ماده با اسید معده به صورت زیر است:
همانطور که می بینید یک مول جوش شیرین، یک مول اسید معده را خنثی می کند.
در ضمن با توجه به فرمول جوش شیرین می توان نتیجه گرفت که فرمول یون چند اتمی هیدروژن کربنات به صورت HCO3 است.
توجه: با توجه به اینکه جوش شیرین یک ضداسید است، می توان گفت محلول این ماده خاصیت بازی دارد؛ به همین دلیل برای افزایش قدرت پاک کنندگی شوینده ها، به آن ها جوش شیرین اضافه می کنند؛ زیرا این مادهء بازی می تواند با چربی ها واکنش داده و صابون تولید کند.
تست 1:
 تست 2:
تست 2:
 تست 3:
تست 3:

تست 4:
 تست 5:
تست 5:
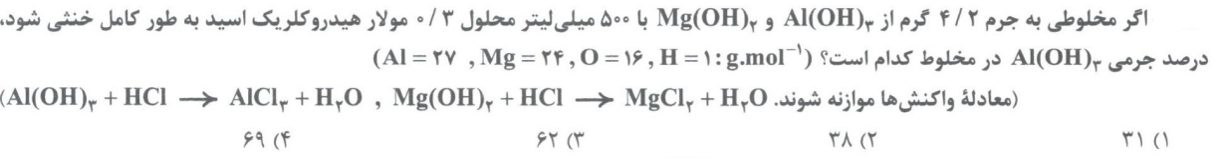
دوستان عزیز می توانید برای دسترسی به نسخه کامل خلاصه نکات به همراه پاسخ فایل پی دی اف زیر را دانلود کنید!
فراموش نکنید اگر سوالی در رابطه با این مبحث داشتید می توانید به راحتی در کامنت ها سوال خود را برای ما بنویسید.
دوستان عزیزم؛ برای ارتباط با رتبه برترها صفحه اینستاگرام زیر رو دنبال کنید.
با آرزوی موفقیت و کامیابی


