سلام
در این مطلب می خواهیم با هم به جمع بندی نکات شیمی دهم (مطابق با آزمون) و خلاصه نکات که برای پاسخگویی به سوالات آزمون باید به آنها مسلط باشید، بپردازیم.
نوید آرمات، دانشجوی مهندسی عمران دانشگاه تهران
سیده محدثه حسینی، دانشجوی دکتری تخصصی پیوسته بیوتکنولوژی دانشگاه تهران
انحلال پذیری
بیشترین مقدار یک ماده بر حسب گرم که در 100 گرم حلال در دمای معین حل می شود، انحلال پذیری آن ماده نامیده می شود.
مواد بر اساس انحلال پذیری در آب در دمای معین به سه دسته تقسیم می شوند:
1- مواد محلول: موادی هستند که انحلال پذیری آن ها در دمای معین بیش از 1 گرم در 100 گرم آب باشد. مانند شکر، سدیم نیترات، سدیم کلرید.
2- مواد نامحلول: موادی هستند که انحلال پذیری آن ها در دمای معین کم تر از 0/01 گرم در 100 گرم آب باشد. مانند کلسیم فسفات، نقره کلرید و باریم سولفات.
3- مواد کم محلول: موادی هستند که انحلال پذیری آن ها در دمای معین بین 0/01 تا 1 گرم در 100 گرم آب باشد. مانند کلسیم سولفات.
محلول سیر نشده: محلولی است که در یک دمای معین، می تواند مقدار بیشتری از ماده ی حل شونده را در خود حل کند، یعنی مقدار ماده ی حل شونده کمتر از مقدار انحلال پذیری آن ماده در همان دما است.
محلول سیر شده: محلولی است که در دمای معین، نمی تواند مقدار بیشتری از ماده ی حل شونده را در خود حل کند.
محلول فرا سیر شده: محلولی است که در دمای معین، مقدار حل شونده ی موجود در آن بیشتر از مقدار انحلال پذیری
آن ماده در همان دما باشد. این محلول ناپایدار است و بر اثر ضربه، تغییر ناگهانی دما و یا اضافه کردن مقداری حل شونده، مقدار اضافی حل شونده در محلول به سرعت رسوب می کند.
همه ی مواد محلول، کم محلول و نامحلولی که باید (در دمای 25 C^°) بلد باشید، در زیر آورده شده:

ایستگاه محاسبات:
نکته: انحلال پذیری نمک ها به نوع آن ها و دما بستگی دارد، ولی تاثیر دما بر مقدار انحلال پذیری آن ها یکسان نیست. نموداری که اثر دما بر انحلال پذیری یک ماده را نشان می دهد، نمودار انحلال پذیری _ دما گویند.
نکته: در این نمودار، نقاط روی منحنی نشان دهنده محلول سیر شده، نقاط زیر منحنی نشان دهنده محلول سیر نشده و نقاط بالای منحنی نشان دهنده محلول فراسیر شده است.
نکته: به طور کلی هر چه شیب نمودار یک ماده بیشتر باشد، تاثیر دما بر انحلال پذیری آن بیشتر است. به عنوان مثال در نمودار روبرو انحلال پذیری KNO3 بیش تر از KCl است.
* در این قسمت با مسائلی سر و کار دارید که مبنای نمودار انحلال پذیری دما می باشد و در آن ها ممکن است مقدار جرم حل شونده، جرم حلال یا جرم رسوب ته نشین شده خواسته شود.
* برای حل این نوع مسائل از روی نمودار می توان انحلال پذیری را در هر دمایی به دست آورد و سپس با توجه به رابطه انحلال پذیری، مقدار حل شونده یا حلال را به دست آورد.

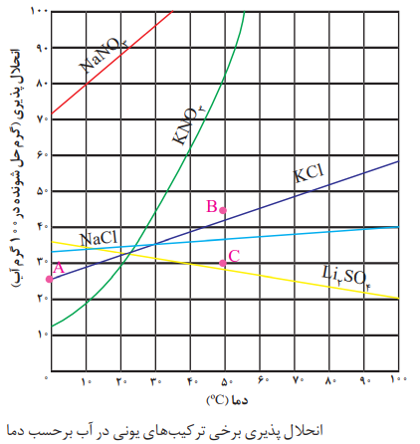
نکته: اگر در مسائلی جرم رسوب تولید شده ضمن کاهش دما (در نمودار های صعودی) و یا افزایش دما (در نمودار های نزولی) خواسته شود، می توان از کسرهای تناسبی زیر استفاده کرد.

نکته: معادله ی خطی که رابطه ی بین انحلال پذیری و دما را نشان می دهد به شرح زیر است: S=aθ+b
در این معادله a و b نشان دهنده ی انحلال پذیری ماده در دمای صفر°C است.
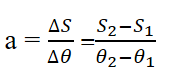
اثر دما بر انحلال پذیری مواد
یکی از عوامل مؤثر بر انحلال پذیری مواد در آب، دما است. با توجه به شکل روبه رو:
نمودار انحلال پذیری برخی مواد مانند KCl، KNO3 ، NaNO3 برحسب دما، صعودی است؛ یعنی با افزایش دما، انحلال پذیری آنها افزایش می یابد.
نمودار انحلال پذیری برخی مواد (مانندLiSO4) برحسب دما نزولی است؛ یعنی با افزایش دما، انحلال پذیری آنها کم می شود.
نمودار انحلال پذیری برخی مواد مانند NaCl برحسب دما به صورت خطی تقریبا افقی است؛ یعنی تغییر دما تأثیر چندانی بر انحلال پذیری آنها ندارد.
* هر چه قدرمطلق شیب نمودار انحلال پذیری یک ماده بیشتر باشد، تأثیر دما بر انحلال پذیری آن ماده بیشتر است.
با توجه به نمودارهای رسم شده، تأثیر دما بر انحلال پذیری KNO3 از همه بیشتر و بر انحلال پذیری NaCl از همه کمتر است.
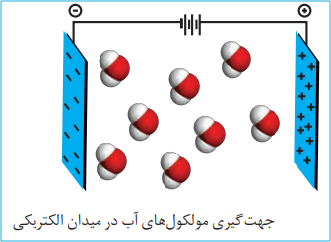
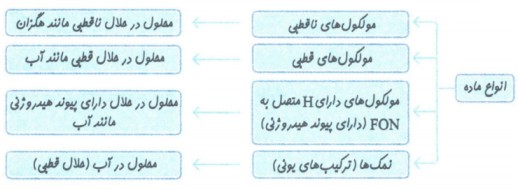
مولکول های قطبی:
نحوۀ جهت گیری مولکول های آب در میدان الکتریکی نشان میدهد که اتم اکسیژن، سرِ منفی و اتمهای هیدروژن، سرِ مثبت مولکول را تشکیل می دهند. شیمیدان ها به مولکول هایی مانند آب که در میدان الکتریکی جهت گیری می کنند، مولکول های دوقطبی یا قطبی می گویند.
مولکول های ناقطبی:
مولکول های سازندۀ ترکیب هایی مانند گاز اکسیژن O2، کربن دی اکسیدCO2 و متان CH4 در میدان الکتریکی جهت گیری نمی کنند چنین مولکول هایی، ناقطبی نامیده میشوند.
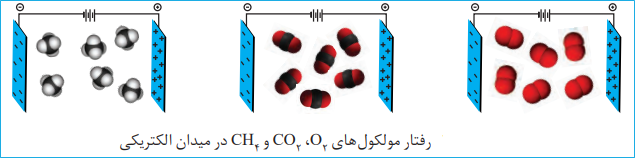
راه های تشخیص مولکول های قطبی و ناقطبی
1- مولکول های دو اتمی که اتم های سازنده آن ها متفاوت هستند، قطبی می باشند. مانند: HF, CO, HCl
2- مولکول های چند اتمی که در آن ها، اتم های اطراف اتم مرکزی متفاوت هستند، قطبی هستند. مانند: COCl2 ، CH2O ، HCN
3- مولکول های چند اتمی که در آن ها اتم مرکزی دارای الکترون ناپیوندی باشد، اغلب قطبی هستند. مانند: NH3 ، SO2 ، O3 و...
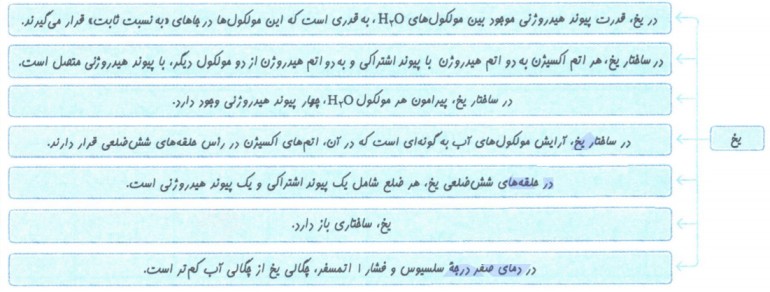
انواع نیروهای بین مولکولی:
میان مولکول های سازنده ی یک ماده بر هم کنش هایی وجود دارد که موجب می شود یک ترکیب بتواند به یکی از 3 حالت گاز، مایع یا جامد در بیاید. به این نیرو ها و برهم کنش ها نیروی بین مولکولی گفته می شود.
نیرو های بین مولکولی عبارت اند از: 1- نیرو های واندروالسی 2- پیوند هیدروژنی
نیرو های واندروالسی به دو عامل بستگی دارد:
1- قطبیت مولکول ها 2- جرم مولی
نکته: به طور کلی هر چه نیرو های بین مولکولی در ترکیبی قوی تر باشد، ترکیب مورد نظر آسان تر از گاز به مایع تبدیل می شود.
پیوند هیدروژنی

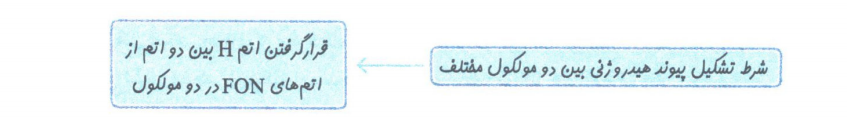
پیوند هیدروژنی:
یکی از انواع نیرو های بین مولکولی است که بین مولکول های دارای اتم هیدروژن متصل به یکی از اتم های F, O, N ایجاد می شود.
حلال های مهم و انحلال پذیری در آن ها:
نکته: آب و اتانول در هر نسبتی در آب حل می شوند و نمی توان محلول سیر شده از آن ها تهیه کرد.
هگزان مانند اغلب هیدروکربن ها، دارای گشتاور دو قطبی ناچیز و در حدود صفر است. بنابراین ناقطبی بوده و در آب حل نمی شود. بنابراین مخلوط آّب و هگزان، مخلوطی ناهمگن است.
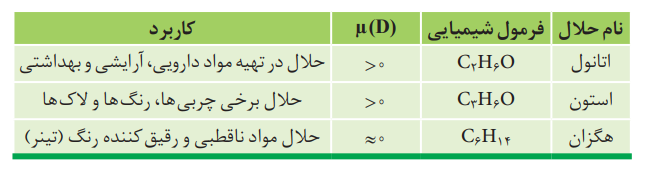
نکته: ترکیبات ناقطبی در حلال های قطبی و یا ترکیبات قطبی در حلال های ناقطبی حل نمی شوند.
فرآیند انحلال زمانی منجر به تشکیل محلول می شود که مقایسه نیروهای جاذبه به صورت زیر باشد:
میانگین جاذبه های حلال خالص و حل شونده خالص ≥ جاذبه ی بین حل شونده و حلال در محلول
انحلال مولکولی:
به انحلال هایی که در آن ها مولکول های حل شونده از یک دیگر جدا شده و سپس به صورت همگن بین مولکول های حلال پخش می شوند، انحلال مولکولی گویند. مانند انحلال اتانول در آب، استون در آب، شکر در آب و یا ید در هگزان.
انحلال یونی:
در این فرآیند ساختار ماده ی حل شونده حفظ نمی شود و یون های سازنده ی بلور تفکیک و آب پوشیده می شوند، این فرآیند انحلال یونی به شمار می رود. مانند:
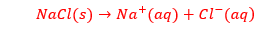
انحلال پذیری گاز ها:
انحلال پذیری گازها در آب به 3 عامل زیر وابسته است:
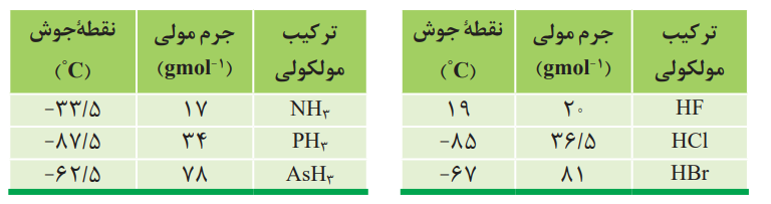
1- نوع گاز: گازهایی که دارای مولکول های قطبی هستند مانند N2 ، O2 و.... در آب که حلال قطبی است، به میزان کمی حل می شوند. ولی گازهایی که دارای مولکول های قطبی هستند مانند N, HCl در آب به میزان بیشتری حل می شوند.
انحلال پذیری N2 ، O2 و NO در فشار ثابت در هر دمایی به صورت مقابل است: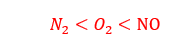
2- دما: انحلال پذیری گاز ها با دما رابطه ی عکس دارد. یعنی با افزایش دما، انحلال پذیری گازها کاهش می یابد و نمودار انحلال پذیری آن ها به صورت نزولی است.
3- فشار: بر طبق قانون هنری انحلال پذیری گازها با فشار رابطه مستقیم دارد. یعنی اگر در دمای ثابت، فشار افزایش داده شود، انحلال پذیری گازها در آب بیش تر می شود.
نکته: به طور کلی با افزایش فشار و کاهش دما، می توان انحلال پذیری یک گاز را در آب افزایش داد.
انحلال رساناها:
به طور کلی به موادی که می توانند جریان الکتریکی را به خوبی عبور دهند، رسانا گفته می شود که به دو دسته تقسیم می شوند:
1- رسانای الکترونی: فلز ها و گرافیت که به وسیله ی الکترون های آزاد خود، جریان را عبور می دهند، رسانای الکترونی نامیده می شوند.
2- رسانای یونی: محلول نمک ها و نمک های مذاب که به واسطه ی یون هایی که آزادانه حرکت می کنند جریان را عبور می دهند، رسانای یونی می گویند.
مواد الکترولیت و غیر الکترولیت
به موادی که بر اثر انحلال در آب، به طورکامل و یا به مقدار کم تفکیک شده و ایجاد یون می کنند، مواد الکترولیت گفته می شود و به محلول حاصل، محلول الکترولیت می گویند. مانند محلول نمک ها یا محلول برخی از ترکیبات قطبی در آب.
الکترولیت ضعیف: موادی هستند که به هنگام انحلال در آب بیش تر به صورت مولکولی حل شده و مقدار کمی از آن ها تفکیک می شوند. اسید ها و بازهای ضعیف مثل:HF, NH_3
الکترولیت قوی: موادی هستند که به هنگام انحلال، به طور کامل به یون تفکیک می شوند. نمک ها، اسید ها و بازهای قوی مانند NaCl, HCl, KOH جز این دسته از مواد هستند.
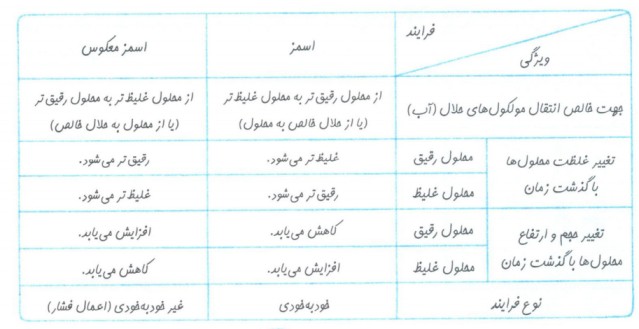
فرآیند اسمز
وقتی میوه های خشک درون آب قرار می گیرند، مولکول های آب خود به خود از محیط رقیق با گذر از روزنه های دیواره سلولی به محیط غلیظ می روند، در نتیجه میوه آبدار می شود، به این فرآیند گذرندگی(اسمز) گفته می شود.
در واقع در فرآیند اسمز مولکول های آب با عبور از غشاء از محلول رقیق تر به سمت محلول غلیظ تر می روند.
اسمز معکوس: مولکول های آب با عبور از غشاء از محلول غلیظ تر به سمت محلول رقیق تر می روند.
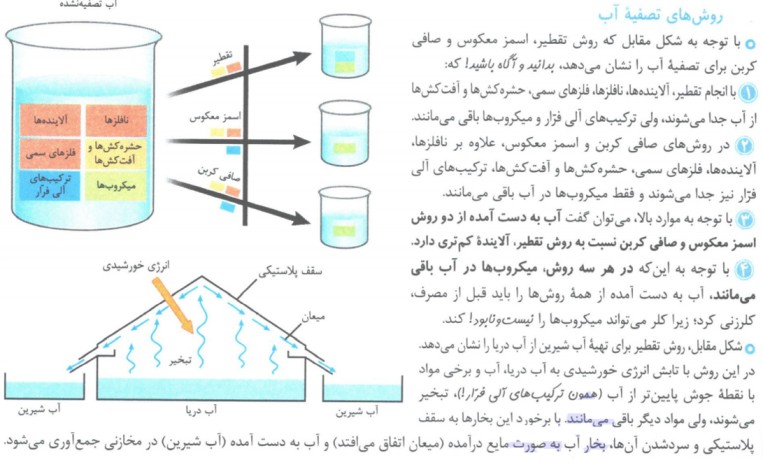
روش های تصفیه آب:
1- اسمز معکوس 2- تقطیر 3- استفاده از صافی کربن
جمع بندی
تست 1 و 2 و 3 :

تست 4 :

تست 5 :

تست 6 :

تست 7 :

دوستان عزیز می توانید برای دسترسی به نسخه کامل خلاصه نکات به همراه پاسخ فایل پی دی اف زیر را دانلود کنید!
فراموش نکنید اگر سوالی در رابطه با این مبحث داشتید می توانید به راحتی در کامنت ها سوال خود را برای ما بنویسید.
دوستان عزیزم؛ برای ارتباط با رتبه برترها صفحه اینستاگرام زیر رو دنبال کنید.
با آرزوی موفقیت و کامیابی


