سلام
در این مطلب میخواهیم با هم به جمع بندی نکات فصل چهارم شیمی دوازدهم (مطابق با آزمون 31 اردیبهشت) و خلاصه نکات که برای پاسخگویی به سوالات آزمون باید به آنها مسلط باشید، بپردازیم.
انرژی فعالسازی:
در واکنش های شیمیایی، به مقدار معینی از انرژی برای شروع واکنش نیاز است. به عبارتی دیگر، صرف نظر از اینکه گرماده یا گرماگیر باشند، برای شروع به حداقلی از انرژی نیاز دارند که آن را با Ea نمایش می دهند و یکای آن کیلو ژول است.
هرچه انرژی فعالسازی واکنش های شیمیایی کم تر باشد، سرعت انجام واکنش های شیمیایی بیشتر است.
انرژی فعالسازی نمی تواند منفی باشد. یکی از روش های تامین این انرژی، گرما دادن به واکنش دهنده ها است.
تاثیر کاتالیزگر بر انرژی فعالسازی:
برخی از واکنش ها در صنعت فقط در دما و فشار بالا انجام می شوند و تولید فرآورده ها درآن ها صرفه اقتصادی ندارد.از این رو شیمی دان ها رد پی یافتن شرایط بهینه (دما و فشار پایین تر) برای انجام چنین واکنش هایی هستند. یکی از راه های انجام واکنش در فشار و دمای پایین و با سرعت مناسب، کاهش انرژی فعالسازی آن است، که با استفاده از کاتالیزگر امکان پذیراست.
ویژگی های کاتالیزگر مناسب:
1- کاتالیزگر اغلب اختصاصی و انتخابی عمل می کند.
2- در حضور کاتالیزگر نباید واکنش های ناخواسته ی دیگری انجام شود.
3- هر کاتالیزگر، نمی تواند همه ی واکنش ها را سرعت ببخشد.
4- هر کاتالیزگر، یک یا شمار معدودی واکنش را سرعت می بخشد.
5- کاتالیزگر در شرایط انجام واکنش باید پایداری شیمیایی و گرمایی مناسب داشته باشد.
عوامل موثر بر تعادل
1- غلظت
2- فشار
3- دما
1- تاثیر غلظت بر تعادل
تغییر غلظت به دو صورت بر تعادل تاثیر گذار است.
1- افزایش غلظت: وقتی غلظت یکی از مواد شرکت کننده در تعادل افزایش می یابد، تعادل در جهت مصرف آن ماده جابه جا می شود.
2- کاهش غلظت: وقتی غلظت یکی از مواد شرکت کننده در تعادل کاهش یابد، تعادل در جهت تولید آن ماده جابه جا می شود.
نکته: در هر یک از این تعییرات، غلطت سایر گونه ها بسته به جهت پیشروی تعادل و متناسب با ضریب استوکیومتری آن ها کم یا زیاد می شود.
نکته: معمولا وقتی غلظت یک ماده در یک تعادل افزایش می یابد، در تعادل جدید، نسبت به تعادل اولیه غلظت آن ماده بیشتر است و بالعکس.
2- تاثیر تغییر حجم (تغییر فشار) بر تعادل
به طور کلی عامل فشار ناشی از تغییر حجم زمانی بر یک سامانه ی تعادلی موثر است که حداقل یکی از مواد موجود در تعادل گازی باشد و اعداد مول های گازی در دو طرف تعادل برابر نباشند.
تاثیرفشار به دو صورت زیر می باشد:
1- چنانچه در یک تعادل گازی فشار سامانه افزایش یابد، تعادل برای جبران آن، در جهتی پیشروی می کند که مول گازی کمتری تولید کند.
2-چنانچه در یک تعادل گازی فشار سامانه کاهش یابد، تعادل برای جبران آن به سمت تولید مول گازی بیشتر پیشرفت می کند.
نکته: در اثر افزایش فشار، سرعت واکنش های رفت و برگشت در هر دو جهت زیاد می شود و معمولا فشار و غلظت تعادلی جدید در تمامی گونه های گازی بیشتر از حالت تعادل اولیه است.
3-تاثیر دما بر تعادل و K
به طور کلی افزایش دما، موجب جابه جایی تعادل در جهت مصرف گرما و کاهش دما، موجب جابه جایی تعادل در جهت مصرف گرما وکاهش دما، موجب جابه جایی تعادل در جهت تولید گرما می شود.
نکته: هنگامی که دمای یک سامانه تغییر می کند، پس از رسیدن به تعادل جدید افزون بر تغییر مواد، مقدار ثابت تعادل هم تغییر می کند و این که K زیاد یا کم شود به گرماگیر یا گرماده بودن واکنش بستگی دارد.
نکته: در تعادل های گرماگیر علامت q در سمت چپ قرار دارد. افزایش دما تعادل در جهت مصرف گرما جا به جا می کنند. بنابراین تعادل در جهت رفت پیشروی می کند. (مصرف واکنش دهنده ها و تولید فرآورده ها) به این ترتیب در تعادل های گرماگیر با افزایش دما مقدار K زیاد می شود.
نکته: در تعادل های گرماده علامت q در سمت راست قرار دارد. افزایش دما تعادل در جهت مصرف گرما جا به جا می کنند. بنابراین تعادل در جهت برگشت پیشروی می کند. به این ترتیب در تعادل های گرماده با افزایش دما مقدار K کم می شود.
نکته: برای تشخیص گرماگیر یا گرماده بودن تعادل هایی که نوع آن ها مشخص نشده، به مجموع تعداد مول های گازی در هرطرف معادله واکنش توجه کنید و علامت گرما q را همواره در سمت تعداد مول گازی کم تر قرار دهد.
نکته: تنهاعامل موثر در مقدار K، دما است و کم و زیاد کردن غلظت و فشار، فقط جهت پیشروی تعادل را تعیین می کند.
توجه: کاتالیزگر زمان فرا رسیدن تعادل را کوتاه می کند. اما غلظت تعادلی گونه ها در حضور و عدم حضور کاتالیزگر یکسان خواهد بود. (زیرا سرعت واکنش های رفت و برگشت را به یک نسبت افزایش می دهد.)
توجه: اگر چه وجود مواد واکنش دهنده جامد یا مایع خالص برای برقراری تعادل الزامی است، اما کاستن یا اضافه کردن آن ها در جابه جا شدن تعادل تاثیری ندارد.
فناوری تولید آمونیاک به روش هابر
در فرآیند تولید آمونیاک، فریتس هابر با کمک عامل موثر بر تعادل توانست شرایط بهینه را برای تعادل پیدا کند. هابر میدانست که با افزایش دما سرعت واکنش افزایش می یابد. به همین دلیل دما را بالا برد ولی متوجه شد که بر طبق اصل لوشاتلیه و جابه جایی تعادل در جهت برگشت پیشرفت واکنش و درصد مولی آمونیاک کاهش می یابد.
بنابراین به جای افزایش بیش از حد دما از کاتالیزگر استفاده کرد و در دماهای به نسبت کمتری واکنش را با سرعت مناسب انجام داد. در ضمن وی از افزایش فشار بر سامانه نیز استفاده کرد و به این ترتیب توانست 28 درصد مولی آمونیاک را در مخلوط نهایی به دست آورد.
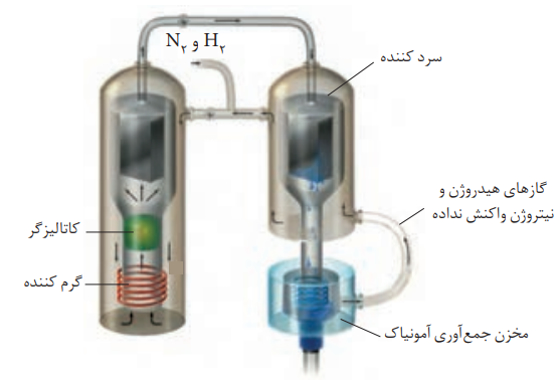
باتوجه به به نقطه ی جوش گازهای آمونیاک، نیتروژن و هیدروژن، هابر از دمای (40- درجه سانتی گراد) برای مایع کردن آمونیاک و خارج کردن آن در دستگاه سرد کننده استفاده کرد.
فناوری را میتوان به کار بردن دانش برای حل یک مسئله درصنعت یا زندگی روزانه برای رسیدن به هدفی خاص دانست. به کارگیری فناوری تبدیل مواد خام به مواد فرآوری شده، سبب رشد و بهره وری اقتصاد یک کشور دانست.
مواد خام و اولیه، موادی مانند نمک، سنگ معدن، نفت خام و هوا هستند که فرآوری نشده اند و با استفاده از آن ها می توان مواد شیمیایی جدید تولید کرد.
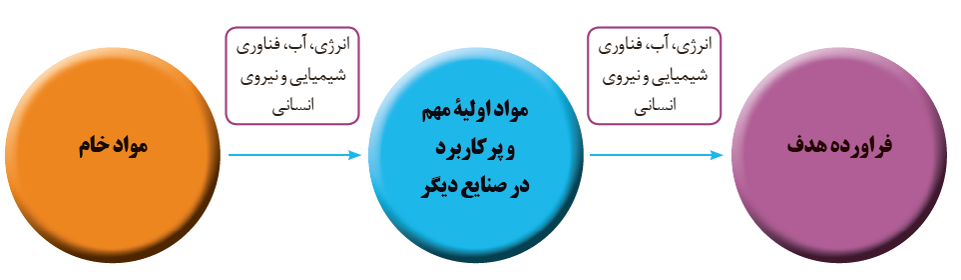
سنتز یک فرآیند شیمیایی هدفمند است که در آن با استفاده از مواد ساده تر، مواد شیمایی دیگر را تولید می کنند. در واقع سنتز را می توان کانون بسیاری از پژوهش های شیمیایی دانست که منجر به طراحی و تولید مواد جدید می شود.
اغلب مواد آلی شامل گروه های عاملی گوناگون هستند. گروه های عاملی آرایش مشخصی از اتم ها هستند ک خواص ورفتار آلی را تعیین می کنند.
تولید یک ماده آلی جدید با کاربردی معین با تغییر ساختار یا ایجاد یک یا چند گروه عاملی همراه باشد.
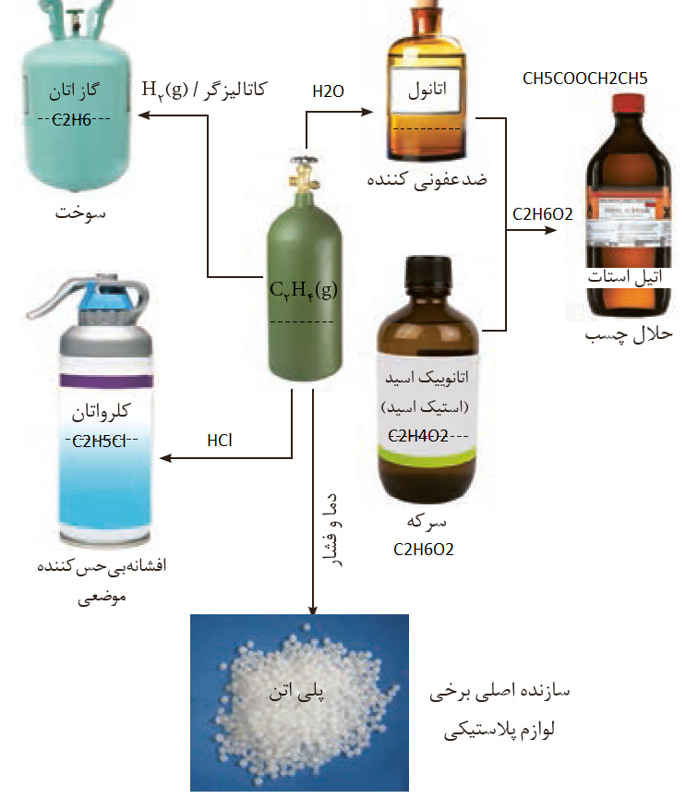
در واکنش های بالا، پیوند دوگانه ی اتن مورد تهاجم قرار می گیرد و به جای پیوند دوگانه، دو اتم جدید، با کربن های تشکیل دهنده ی پیوند دو گانه برقرار می کنند. این پیوند دوگانه، عامل واکنش پذیری بالای اتن است.
1. الکل ها بسته به محل قرار گیری گروه هیدروکسیل (-OH) قادرند اکسید شوند و به کتون و آلدهید تبدیل شوند و در صورت شدید بودن اکسایش آلدهیدها نیز می توانند به کربوکسیلیک اسید تبدیل شوند. در طی انجام هر مرحله از این واکنش های اکسایش-کاهش، عدد اکسایش اتم کربن مربوط به گروه عاملی یا متصل به آن 2 واحد افزایش می یابد.
2. در اثر حذف گروه هیدروکسیل الکل ها و قرار دادن گروه آمینی (NH3-) به جای آن ها، می توان الکل ها را به آمین تبدیل کرد.
3. هر چه نوع و تعداد گروه های عاملی، در مولکول هدف بیش تر باشد، ساخت آن دشوارتر بوده و به دانش پیشرفته تر و فناوری کارآمدتری نیاز دارد. از این رو شیمیدان ها در پی یافتن مواد مناسب، ارزان و دوستدار محیط زیست و واکنش های شیمیایی آسان و پربازده هستند تا هزینه تمام شده تولید یا سنتز را کاهش دهند و در گام بعد به دنبال طراحی و اجرای فناوری لازم هستند.
بازده واکنش، هزینه مواد و انرژی مصرف شده برای تولید ماده هدف به دو عامل بستگی دارد:
1- نوع واکنش 2- فناوری به کار رفته
سالانه شمار بسیار زیادی بطری پلاستیکی برای نگه داری و بسته بندی آب آشامیدنی تولید می شود. بطری آب از پلیمری به نام پلی اتیلن ترفتالات PET ساخته می شود. برای ساخت این بطری، نخست پلیمر آن را تهیه می کنند. سپس این پلیمر را به همراه برخی افزودنی ها در قالب های ویژه ای می ریزند تا به شکل بطری مورد نظر در آید.
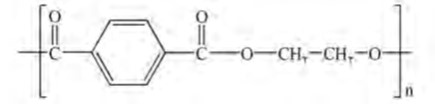
ساختار شیمیایی پارازایلن و ترفتالیک اسید شباهت زیادی به یکدیگر دارد. که با جایگزینی گروه های متیل پارازایلن با گروه های کربوکسیل، ترفتالیک اسید تولید می شود. این نوع واکنش، در گروه واکنش های اکسایش-کاهش قرار می گیرد؛ زیرا عدد اکسایش هر یک از اتم های کربن در متیل (3-) و کربن کربوکسیل (3+) است بنابراین برای انجام این واکنش به یک اکسنده نیاز است تا بتواند کربن های گروه متیل در پارازایلن را اکسید کند.
از واکنش مونومرهای سازنده این پلیمر یعنی اتیلن گلیکول (الکل دوعاملی) با ترفتالیک اسید (اسید دوعاملی) در شرایط مناسب می توان پلی اتیلن ترفتالات را سنتز کرد.
اما مسئله این است که اتیلن گلیکول و ترفتالیک اسید در نفت خام وجود ندارند. به دیگر سخن، به طور مستقیم نمی توان آنها را از نفت خام به دست آورد.

ویژگی پلاستیک ها
1. چگالی کم
2. نفوذ ناپذیری نسبت به هوا و آب ارزان بودن مقاومت در برابر خوردگی
3. زیست تخریب ناپذیر
مراحل کلی بازیافت
1. بازیافت
2. انجام فرآیندهای فیزیکی و شیمیایی
3. تبدیل ماده ی اولیه به مواد قابل استفاده
یکی از راه های بازیافت این است که پلاستیک را پس از شسشو و تمیز کردن، ذوب کرده و دوباره از آن ها برای تولید وسایل و ابزار دیگر استفاده می کنند.
روش فیزیکی
همچنین پس از شستشوی مواد پلاستیکی آنها را خرد کرده و به تکه های کوچک به نام پرک تبدیل و در تولید مواد پلاستیکی دیگر استفاده کرد.
روش شیمیایی
در روش دیگر پسماندها را به مونومرهای سازنده یا مواد اولیه مفید و ارزشمند تبدیل می کنند.
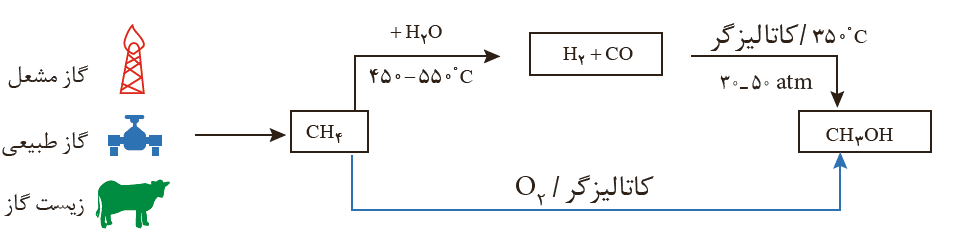
متانول مایعی بی رنگ، بسیار سمی و ساده ترین عضو خانواده الکل ها است که می توان آن را از چوب تهیه کرد. از آنجا که این الکل کاربردهای زیادی در صنایع گوناگون دارد باید آن را در مقیاس صنعتی تولید کرد. در صنعت گاز کربن مونوکسید را با گاز هیدروژن در شرایط مناسب و در حضور کاتالیزگر واکنش می دهند. معادله شیمیایی این واکنش به صورت زیر است:

مواد واکنش دهنده برای این واکنش در دسترس نیستند از این رو نخست باید آن ها را تولید و سپس به متانول تبدیل کرد. برای تهیه گازهای کربن مونوکسید و هیدروژن می توان از واکنش گاز متان با بخار آب در حضور کاتالیزگر بهره برد.

گاز متان سازنده اصلی گاز طبیعی است که در میدان های نفتی به فراوانی یافت می شود. دراین میدان ها برای افزایش ایمنی، بخش قابل توجهی از آن را می سوزانند. گاز متان واکنش پذیری بسیار کمی دارد وتبدیل آن به متانول فرایندی دشوار است که انجام آن به دانش و فناوری پیشرفته نیازمند است. به دلیل اهمیت متانول در صنایع گوناگون ازیک سو و ارزان بودن گاز متان از سوی دیگر، پژوهش های شیمیایی زیادی در حال انجام است تا بتوان روشی برای تبدیل گاز متان به متانول پیدا کرد.
دوستان عزیز می توانید برای دسترسی به نسخه کامل خلاصه نکات به همراه پاسخ فایل پی دی اف زیر را دانلود کنید!
فراموش نکنید اگر سوالی در رابطه با این مبحث داشتید می توانید به راحتی در کامنت ها سوال خود را برای ما بنویسید.
دوستان عزیزم ما تصمیم گرفتیم برای اینکه بتونیم ارتباطمون رو با هم بیشتر کنیم و قدم به قدم کنارتون باشیم، صفحه ی اینستاگرام متا رو بسازیم
و همراهتون باشیم.
با آرزوی موفقیت و کامیابی
گلنوش بیرانوند، دانشجوی مهندسی شیمی دانشگاه شریف
نوید آرمات، دانشجوی مهندسی عمران دانشگاه تهران


