سلام دوستان عزیز
در این مطلب می خواهیم به جمع بندی خلاصه نکات و حفظیات مبحث آمونیاک و عوامل موثر بر تعادل از شیمی دوازدهم مطابق با بودجه بندی آزمون 2 اردیبهشت که برای پاسخگویی به سوالات آزمون باید به آنها مسلط باشید، بپردازیم.
| دانشجوی مهندسی عمران دانشگاه تهران رتبه 328 منطقه دو - کنکور ریاضی 1398 |
برای ارتباط بیشتر با برترها و رزرو پشتیبان ویژه، پیج کانون برترها را دنبال کنید، همچنین میتونید با شماره ۰۲۱۸۴۵۱ داخلی ۳۱۲۳ تماس بگیرید.
بودجه بندی فصل چهارم در کنکور سال های اخیر
آمونیاک و بهره وری در کشاورزی
گیاهان با جوی سرشار از نیتروژن احاطه شده اند اما نمی توانند این عنصر ضروری برای رشد را به طور مستقیم از هوا جذب کنند. نیتروژن را باید به شکل ترکیب های نیتروژن دار از جمله آمونیاک و اوره به خاک افزود. در برخی از کشورها برای افزایش بازده فرآورده های کشاورزی، آمونیاک مایع را به عنوان کود شیمیایی به طور مستقیم به خاک تزریق می کنند.
نکته: گیاهان افزون بر CO_2 و H_2 O به عناصری مانند S, N, P, K و... نیاز دارند.
تعادل آمونیاک و تاثیر غلظت مواد بر تعادل های گازی
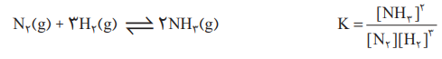
در تعادل هایی که K بزرگ است، مقدار زیادی از واکنش دهنده ها به فرآورده ها تبدیل می شوند و در شرایطی که مقدار ثابت تعادل خیلی زیاد باشد، می توان واکنش را کامل و یک طرفه در نظر گرفت و با محاسبات استوکیومتری مقدار نهایی فرآورده ها را بدست آورد. اما در مواردی که K کوچک است، در تعادل غلظت واکنش دهنده ها بیشتر از فرآورده هاست و غلظت تعادلی مواد از طریق محاسبات تعادلی(کسر تعادل) قابل به دست آوردن است.
توجه: در کسر مربوط به تعادل، غلظت های تعادلی گونه ها قرار می گیرد. اگر غلظت هایی جز غلظت های تعادلی قرار بگیرد، مقدار کسر برابر با K و برای این کسر جدید دو حالت پیش می آید.
1- کوچکتر از K باشد؛ واکنش در جهت مصرف واکنش دهنده ها و تولید فرآورده ها (جهت رفت) پیش می رود تا به تعادل برسد.
2- بزرگتر از K باشد؛ تعادل در جهت مصرف فرآورده ها و تولید واکنش دهنده ها (جهت برگشت) پیش می رود تا به تعادل برسد.
نکته: اگر تغییری هم سبب به هم خوردن یک سامانه تعادلی شود، تعادل در جهتی جابه جا می شود که تا حد امکان (به صورت کامل یا ناقص) اثر آن تغییر را جبران کند. این توصیف از اصل لوشاتلیه است.
عوامل موثر بر تعادل عبارت اند از: 1- غلظت 2- فشار 3- دما
1- تاثیر غلظت بر تعادل
تغییر غلظت به دو صورت بر تعادل تاثیر گذار است.
1- افزایش غلظت: وقتی غلظت یکی از مواد شرکت کننده در تعادل افزایش می یابد، تعادل در جهت مصرف آن ماده جایه جا می شود.
2- کاهش غلظت: وقتی غلظت یکی از مواد شرکت کننده در تعادل کاهش یابد، تعادل در جهت تولید آن ماده جابه جا می شود.
نکته: در هر یک از این تعییرات، غلطت سایر گونه ها بسته به جهت پیشروی تعادل و متناسب با صریب استوکیومتری آن ها کم یا زیاد می شود.
نکته: معمولا وقتی غلظت یک ماده در یک تعادل افزایش می یابد، در تعادل جدید، نسبت به تعادل اولیه غلظت آن ماده بیشتر است و بالعکس.
2- تاثیر تغییر حجم (تغییر فشار) بر تعادل
به طور کلی عامل فشار ناشی از تغییر حجم زمانی بر یک سامانه ی تعادلی موثر است که حداقل یکی از مواد موجود در تعادل گازی باشد و اعداد مول های گازی در دو طرف تعادل برابر نباشند.
تاثیر فشار به دو صورت زیر می باشد:
1- چنانچه در یک تعادل گازی فشار سامانه افزایش یابد، تعادل برای جبران آن، در جهتی پیشروی می کند که مول گازی کم تری تولید کند.
2- چنانچه در یک تعادل گازی فشار سامانه کاهش یابد، تعادل برای جبران آن به سمت تولید مول گازی بیشتر پیشرفت می کند.
نکته: در اثر افزایش فشار، سرعت واکنش های رفت و برگشت در هر دو جهت زیاد می شود و معمولا فشار و غلظت تعادلی جدید در تمامی گونه های گازی بیشتر از حالت تعادل اولیه است.
3- تاثیر دما بر تعادل و K
به طور کلی افزایش دما، موجب جابه جایی تعادل در جهت مصرف گرما و کاهش دما، موجب جابه جایی تعادل در جهت مصرف گرما و کاهش دما، موجب جابه جایی تعادل در جهت تولید گرما می شود.
نکته: هنگامی که دمای یک سامانه تغییر می کند، پس از رسیدن به تعادل جدید افزون بر تغییر مواد، مقدار ثابت تعادل هم تغییر می کند و اینکه K زیاد یا کم ش.د به گرماگیر یا گرماده بودن واکنش بستگی دارد.
نکته: در تعادل های گرماگیر∆H>0 علامت q در سمت چپ قرار دارد. افزایش دما تعادل در جهت مصرف گرما
جا به جا می کنند. بنابراین تعادل در جهت رفت پیشروی می کند. (مصرف واکنش دهنده ها و تولید فرآورده ها)
به این ترتیب در تعادل های گرماگیر با افزایش دما مقدار K زیاد می شود.
نکته: در تعادل های گرماده∆H<0 علامت q در سمت راست قرار دارد. افزایش دما تعادل در جهت مصرف گرما جا به جا می کنند. بنابراین تعادل در جهت برگشت پیشروی می کند. به این ترتیب در تعادل های گرماده با افزایش دما مقدار K کم می شود.
نکته: برای تشخیص گرماگیر یا گرماده بودن تعادل هایی که نوع آن ها مشخص نشده، به مجموع تعداد مول های گازی در هرطرف معادله واکنش توجه کنید و علامت گرما q را همواره در سمت تعداد مول گازی کم تر قرار دهد.
نکته: تنها عامل موثر در مقدار K، دما است و کم و زیاد کردن غلظت و فشار، فقط جهت پیشروی تعادل را تعیین می کند.
توجه: کاتالیزگر زمان فرا رسیدن تعادل را کوتاه می کند. اما غلظت تعادلی گونه ها در حضور و عدم حضور کاتالیزگر یکسان خواهد بود. (زیرا سرعت واکنش های رفت و برگشت را به یک نسبت افزایش می دهد.)
توجه: اگرچه وجود مواد واکنش دهنده جامد یا مایع خالص برای برقراری تعادل الزامی است، اما کاستن یا اضافه کردن آن ها در جابه جا شدن تعادل تاثیری ندارد.
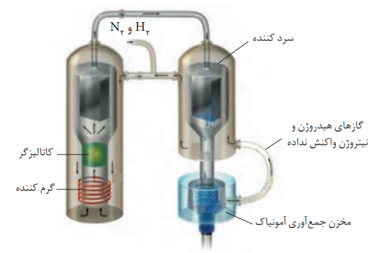
فناوری تولید آمونیاک به روش هابر
در فرآیند تولید آمونیاک، فریتس هابر با کمک عامل موثر بر تعادل توانست شرایط بهینه را برای تعادل پیدا کند. هابر می دانست که با افزایش دما سرعت واکنش افزایش می یابد. به همین دلیل دما را بالا برد ولی متوجه شد که بر طبق اصل لوشاتلیه و جابه جایی تعادل در جهت برگشت پیشرفت واکنش و درصد مولی آمونیاک کاهش می یابد.
بنابراین به جای افزایش بیش از حد دما از کاتالیزگر استفاده کرد و در دماهای به نسبت کمتری واکنش را با سرعت مناسب انجام داد. در ضمن وی از افزایش فشار بر سامانه نیز استفاده کرد و به این ترتیب توانست 28 درصد مولی آمونیاک را در مخلوط نهایی به دست آورد.
با توجه به نقطه ی جوش گازهای آمونیاک، نیتروژن و هیدروژن، هابر از دمای (C40-) برای مایع کردن آمونیاک و خارج کردن آن در دستگاه سرد کننده استفاده کرد.

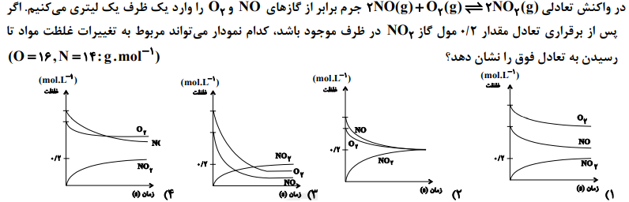
متوسط – آزمون کانون قلم چی 99


متوسط – آزمون کانون قلم چی 99


ساده – آزمون کانون قلم چی 99


سخت – آزمون کانون قلم چی 1400


سخت – آزمون کانون قلم چی 1400
دوستان عزیز می توانید برای دسترسی به نسخه کامل خلاصه نکات به همراه پاسخ، فایل پی دی اف زیر را دانلود کنید!
فراموش نکنید اگر سوالی در رابطه با این مبحث داشتید می توانید به راحتی در کامنت ها سوال خود را برای ما بنویسید.
دوستان عزیزم؛ برای ارتباط با رتبه برترها صفحه اینستاگرام زیر رو دنبال کنید.
با آرزوی موفقیت و کامیابی




