سلام دوستان عزیز
در این مطلب می خواهیم به جمع بندی خلاصه نکات و حفظیات فصل اول شیمی دهم مطابق با بودجه بندی آزمون های جمع بندی و کنکور بپردازیم.
| دانشجوی مهندسی عمران دانشگاه تهران رتبه 328 منطقه دو - کنکور ریاضی 1398 |
برای ارتباط بیشتر با برترها و رزرو پشتیبان ویژه، پیج کانون برترها را دنبال کنید، همچنین میتونید با شماره ۰۲۱۸۴۵۱ داخلی ۳۱۲۳ تماس بگیرید.
بودجه بندی فصل اول در کنکور سال های اخیر
نظریه ی مهبانگ

بر اثر واکنش های هسته ای انرژی آزادی می شود که از رابطه ی اینشتین E = mc^2 به دست می آید.
در این رابطه، m جرم ماده (Kg) و c سرعت نور 8^10 × 3 متر بر ثانیه است و E بر حسب ژول می باشد.
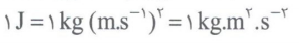
ذره های زیر اتمی، ایزوتوپ
به طور کلی ذره های سازنده ی هر اتم، زیر اتمی نامیده می شوند که مهم ترین آن ها عبارت است از: الکترون، پروتون و نوترون.
عدد اتمی نشان دهنده ی تعداد پروتون های هسته اتم است که با حرف z نشان داده می شود.
عدد جرمی، نشان دهنده مجموع تعداد پروتون ها و نوترون های هسته اتم است که با حرف A نشان داده می شود.
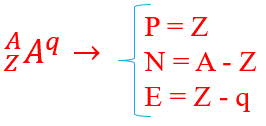
ایزوتوپ (هم مکان): به اتم هایی از یک عنصر، که دارای عدد اتمی یکسان و عدد جرمی متفاوتی هستند، گفته می شود.
نکته: ایزوتوپ ها خواص شیمیایی یکسانی دارند ولی برخی خواص فیزیکی وابسته به جرم آن ها مانند چگالی متفاوت است.
جدول دوره ای عنصر ها
جدول تناوبی دارای 7 دوره(تناوب) و 18 گروه است.
خواص شیمیایی عنصر هایی که در یک گروه قرار دارد مشابه و خواص عناصر هم دوره متفاوت است. به عنوان مثال هلیم و آرگون متعلق به گروه 18 هستند، تمایل به انجام واکنش ندارند.
با پیمایش هر دوره از چپ به راست، خواص عنصر ها به طور تناوبی و مشابه هم تکرار می شود.
در این جدول، دوره ی اول با 2 عنصر کوتاه ترین و دوره ی6 و 7 با 32 عنصر بلند ترین دوره های جدول دوره ای هستند.
عناصر گروه 18 (گاز های نجیب) تمایلی به انجام واکنش شیمیایی ندارند. یا واکنش پذیری کمی دارند، مثل He, Ar
عناصر گروه 17 (هالوژن ها) یون پایدار( -X ) را تشکیل می دهند، مانندF, Cl, Br
جرم اتمی عنصر ها
دانشمندان برای اندازه گیری جرم اتم ها، از یکای جرم اتمی(amu) استفاده می کنند. جرم هر (amu) معادل 1/12 جرم ایزوتوپ ، «کربن-12» است.
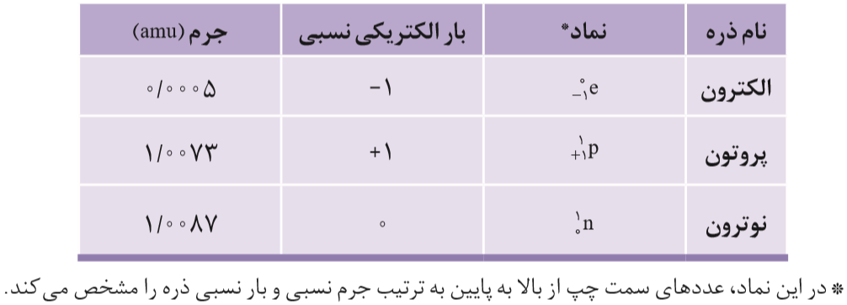
نکته: با توجه به اینکه جرم نسبی پروتون و نوترون حدود amu 1 است می توان گفت، جرم نسبی یک اتم تقریبا معادل با عدد جرمی آن است.
ایستگاه محاسبات:
برای محاسبه ی جرم اتمی میانگین از فرمول زیر استفاده می کنیم:
جرم های ایزوتوپ های عنصر: a1 , a2 , a3 فراوانی ایزوتوپ های عنصر: F1 , F2 , F3
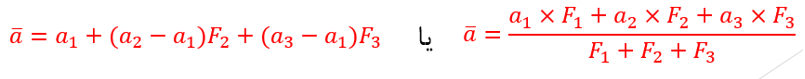
•برای اینکه بتوان جرم اتم ها را بر حسب گرم بیان کرد، دانشمندان«مول» را معرفی کردند. شیمی دان ها به تعداد 1023 × 6.02 از هر ذره (اتم، مولکول یا یون) یک مول از آن ذره می گویند و آن را با mol نشان می دهند.
•به افتخار شیمی دان ایتالیایی، آمدئو آووگادرو، یه عدد 1023 × 6.02، عدد آووگادرو گفته می شود و آن را با NA نشان می دهند.
نکته: عدد آووگادرو معکوس جرم یک amu بر حسب گرم است: 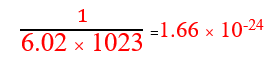
تست 1:
اگر یون +A2 دارای 121 نوترون و 78 الکترون و یون -B3 دارای 41 نوترون و 36 الکترون باشد، تفاوت عدد اتمی و تفاوت عدد جرمی دو عنصر A و B به ترتیب از راست به چپ، کدام است؟
1) 47 – 126 2) 43 – 126 3) 47 – 127 4) 43 – 127

پرتوهای الکترومغناطیس
نور، شکلی از انرژی است که به صورت موج منتشر می شود. یکی از ویژگی های موج، طول موج(λ) است.
نکته: میزان شکست نور با طول موج رابطه ی عکس دارد، مثلا شکست نور بنفش از نور قرمز بیش است.
به طور کلی هر چه طول موج پرتویی کوتاه تر باشد، انرژی بیش تری با خود حمل می کند. به عنوان مثال انرژی نور آبی از نور سرخ بیش تر است.
امواج رادیویی < ریز موج ها < فرویرخ< نور مرئی < فرابنفش < ایکس < گاما : انرژی
به فرآیندی که در آن یک ماده با جذب انرژی از خود نور(پرتوهای الکترومغناطیس) منتشر می کنند، نشر نور گفته می شود.
اگر نور نشرشده از یک عنصر یا ترکیب دارای آن عنصر را از منشور عبور دهیم، الگویی شامل خط ها یا نوارهای مجزای رنگی به وجود می آید که به آن طيف نشری خطی می گویند. طیف نشری خطی هر عنصر مختص همان عنصر است و می توان از آن برای شناسایی عناصر استفاده کرد.
مدل کوانتومی اتم:
1- در این مدل اتم مانند کره ای در نظر گرفته می شود که هسته در فضایی بسیار کوچک در مرکز آن قرار دارد.
2- الکترون ها در فضایی بسیار بزرگ تر و در لایه هایی اطراف هسته توزیع می شود.
(لایه ها به ترتیب از طرف هسته به بیرون با شماره های 1، 2 و ... شماره گذاری می شوند.)
3- شماره هر لایه با (n) عدد کوانتومی اصلی، نمایش داده می شود.
4- در ساختار لایه ای، بخش های پررنگ تر، مهم ترین بخش از یک لایه را نشان می دهند که الکترون بیش تر وقت خود را در آن فاصله سپری میکند. (الکترون ها مابقی وقت خود را می توانند در همه ی نقاط پیرامون هسته حضور داشته باشند.)
5- در این مدل، داد و ستد انرژی به صورت کوانتومی صورت می گیرد. یعنی الکترون هنگام انتقال از یک لایه به لایه دیگر انرژی را به صورت پیمانه ای یا بسته ای جذب یا نشر می کند.
توزیع الکترون ها در لایه ها و زیر لایه ها
همانطور که در بخش قبلی آموختید، اتم ساختار لایه ای دارد و این لایه ها با عدد کوانتومی اصلی(n) نشان داده می شوند که مقادیر ان می تواند از n=1,2,…,7 باشد.
در مدل کوانتومی اتم، به هر نوع زیر لایه، عدد کوانتومی خاصی نسبت می دهند که با I نشان داده می شود و عدد کوانتومی فرعی نامیده می شود.
برای هر یک از مقادیر عددیI ، معمولا حروف در نظر گرفته می شود که به صورت جدول زیر است:
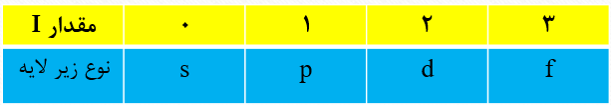
حداکثر گنجایش هر لایه از رابطه (2n2) و حداکثر گنجایش هر زیر لایه از رابطه (4I+2) به دست می آید.
قاعده ی آفبا
روند پر شدن زیرلایه ها در اطرف هسته تنها به عدد کوانتومی اصلی وابسته نیست بلکه از قاعده کلی به نام آفبا پیروی می کند.
بر طبق این قاعده، هنگام افزودن الکترون به زیرلایه ها، نخست زیرلایه های نزدیک تر به هسته پر می شوند که دارای انرژی کم تری هستند و سپس زیرلایه های بالاتر پر خواهند شد.
ترتیب پر شدن زیرلایه ها به صورت مقابل است:
1s → 2s → 2p → 3s → 3p →4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d →6p → 7s → 5f → 6d → 7p
تست 2:
در میان موارد زیر چند عبارت نادرست هستند؟
آ- پرتوهای الکترومغناطیسی، بخش کوچکی از نور مرئی را تشکیل می دهند.
ب- طول موج (λ)، فاصله ی بین دو برجستگی است که بین آن ها دو فرورفتگی نیز قرار دارند.
پ- مجموعه ای از هفت نور رنگی که در گستره ی مرئی قرار دارند، نور خورشید را تشکیل می دهند.
ت- در یک شعله ی معین (مانند شعله ی شمع) دمای قسمت آبی از دمای قسمت زرد بالاتر است.
1) 1 2) 2 3) 3 4) 4
تعیین موقعیت عنصرها در جدول دوره ای عناصر
با استفاده از آرایش الکترونی عنصار می توان شماره دوره و گروه عنصر را به ترتیب زیر معین کرد.
آ) بزرگترین (n) عدد کوانتومی اصلی در آرایش الکترونی نشان دهنده ی شماره دوره آن است.
ب) برای تعیین شماره گروه عناصر، سه حالت پیش می آید:
1- اگر عنصر متعلق به دسته (s) باشد، شماره گروه آن برابر با توان (s) است.
2- اگر عنصر متعلق به دسته (p) باشد، شماره گروه آن برابر با (توان 12+ p) است.
3- اگر عنصر متعلق به دسته (d) باشد، شماره گروه آن برابر با (توان d + توان s) است.
نکته: لایه طرفیت، بیرونی ترین لایه ی اتم و لایه ای است که الکترون های آن، رفتار شیمیایی اتم را تعیین می کند.
تست 3:
چند مورد از مطالب زیر، نادرست اند؟
•یکی از زیرلایه های موجود در لایهء الکترونی سوم، در عنصرهای دورهء چهارم جدول شروع به پرشدن می کند.
•زیرلایه ای که مجموع n+l آن برابر یک است، در عنصرهای دورهء اول جدول پر می شود.
•در عنصرهای دورهء چهارم جدول، زیرلایه های s4، p4، d4 و f4 در حال پرشدن هستند.
•ترتیب پرشدن زیرلایه های p6، s6، f4، d5 به صورت s6 ← f4 ← d5 ← p6 است.
1) 1 2) 2 3) 3 4) 3
آرایش الکترونی یون ها
برای نوشتن آرایش یون مثبت، بعد از نوشتن آرایش الکترونی اتم، به تعداد بار یون از آخرین زیر لایه (زیر لایه دارای n بزرگتر) الکترون ها را جدا کنید و اگر زیر لایه آخر الکترون کافی نداشت، از زیر لایه ما قبل آخر الکترون جدا کنید.
اگر آرایش الکترونی کاتیونی داده شود و بخواهیم آن را به آرایش الکترونی اتم تبدیل کنیم، کافی است که به تعداد بار و به ترتیب پرشدن زیرلایه ها، به آن الکترون اضافه کنیم.
برای نوشتن آرایش یون منفی، ابتدا آرایش الکترونی اتم مورد نظر را نوشته و سپس به تعداد بار یون به آخرین زیر لایه موجود الکترون اضافه کنید.
اگر آرایش الکترونی آنیونی داده شود و آرایش الکترونی اتم خنثی را بخواهید، کافی است به تعداد بار آنیون، از آخرین زیر لایه موجود در آنیون الکترون کم کنید.
ترکیب های یونی
دو نوع اتم که در شرایط مناسب در کنار هم قرار می گیرند، با هم الکترون داد و ستد میکنند، یه طوری که یکی به یون مثبت و دیگری به یون منفی تبدیل می شود. در این مواقع میان یون های تولید شده به دلیل وجود بارهای الکتریکی ناهم نام، نیروی جاذبهء بسیار قوی برقرار می شود که به آن پیوند یونی و به ترکیب حاصل، ترکیب یونی می گویند.
•هر ترکیب یونی از لحاظ بار الکتریکی خنثی است؛زیرا مجموع بار الکتریکی کاتیون ها با مجموع بار الکتریکی آنیون ها برابر است.
تبدیل اتم ها به مولکول ها
همان طور که قبلا گفتیم، یکی از روش های رسیدن به آرایش پایدار گاز نجیب، به اشتراک گذاشتن الکترون است. پیوندی که ناشی از به اشتراک گذاشتن الكترون بین دو اتم است، پیوند اشتراکی یا کووالانسی نامیده میشود. در مولکول ها به جای این که الکترون دادوستد شود، الکترون به اشتراک گذاشته می شود.
مثال: گاز کلر که خاصیت رنگ بری و گندزدایی دارد، از مولکولهای دواتمی Cl2تشکیل شده است.
در آرایش الکترون - نقطه ای اتم کلر، یک الکترون جفت نشده وجود دارد؛ بنابراین هر اتم کلر به دنبال آن است که تک الکترون خود را با تک الکترون اتم کلر دیگر به اشتراک بگذارد تا هر دو به آرایش هشت تایی برسند. با تشکیل مولکول Cl2، دو الکترون موجود بین دو اتم، به هر دوی آنها تعلق دارد. به این جفت الکترون اشتراکی، پیوند اشتراکی (کووالانسی) می گویند.
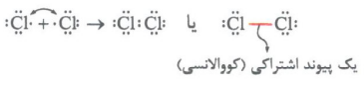
تست 4:

هوا کره
روند تغییر دمای هواکره در محدوه های مختلف متفاوت است. که این امر نشان از لایه ای بودن هواکره است.
* هواکره دارای 4 لایه متفاوت است که به ترتیب از سطح زمین تروپوسفر، استراتوسفر، مزوسفر و ترموسفر نامیده می شوند. که در کتاب درسی تنها 3 تای اول نام برده شده است.
1- در لایه ی اول (تروپوسفر) که نزدیک ترین لایه ی هواکره به سطح زمین است، با افزایش ارتفاع و فاصله از سطح زمین، دما کاهش می یابد. در این لایه با افزایش ارتفاع به ازای هر کیلومتر، دما 6°C کاهش می یابد. به طوری که از 11 درجه سانتی گراد به 55- درجه سانتی گراد می رسد.
2- در لایه ی دوم (استراتوسفر) با افزایش ارتفاع، دما افزایش می یابد به طوری که از 55- درجه سانتی گراد به حدود 7درجه سانتی گراد می رسد، که این امر به دلیل جذب تابش های فرابنفش توسط مولکول های اوزون قرار گرفته در این لایه است.
3- در لایه ی سوم (مزوسفر) با افزایش ارتفاع، دما کاهش می یابد و از 7درجه سانتی گراد به حدود 87-درجه سانتی گراد می رسد.
تغییرات آب و هوایی در لایه ی تروپوسفر یعنی از سطح زمین تا ارتفاع 10- 12 کیلومتری سطح آن اتفاق می افتد.
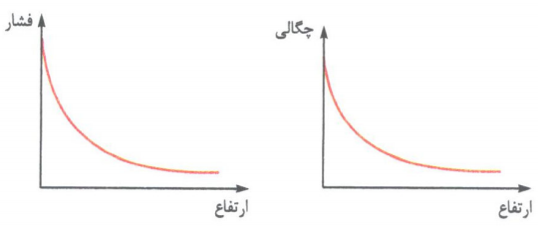
هواکره به دلیل داشتن گازهای گوناگون، فشار دارد! با افزایش ارتفاع در هواکره (در همه لایه ها) هواکره رقیق تر می شود؛ از این رو با فاصله گرفتن از زمین، چگالی و همین طور فشار هوا کاهش می یاید.
* میزان کاهش فشار در ارتفاع های پایین تر بیشتر است.
تست 5:

دوستان عزیز می توانید برای دسترسی به نسخه کامل خلاصه نکات به همراه پاسخ فایل پی دی اف زیر را دانلود کنید!
فراموش نکنید اگر سوالی در رابطه با این مبحث داشتید می توانید به راحتی در کامنت ها سوال خود را برای ما بنویسید.
دوستان عزیزم؛ برای ارتباط با رتبه برترها صفحه اینستاگرام زیر رو دنبال کنید.
با آرزوی موفقیت و کامیابی




