سلام
در این مطلب می خواهیم با هم به جمع بندی نکات شیمی 1 از صفحه ی 36 تا 44 (مطابق با آزمون) و خلاصه نکات که برای پاسخگویی به سوالات آزمون باید به آنها مسلط باشید، بپردازیم.
نوید آرمات، دانشجوی مهندسی عمران دانشگاه تهران
سیده محدثه حسینی، دانشجوی دکتری تخصصی پیوسته بیوتکنولوژی دانشگاه تهران
آرایش الکترونی یون ها
برای نوشتن آرایش یون مثبت، بعد از نوشتن آرایش الکترونی اتم، به تعداد بار یون از آخرین زیر لایه (زیر لایه دارای n بزرگتر) الکترون ها را جدا کنید و اگر زیر لایه آخر الکترون کافی نداشت، از زیر لایه ما قبل آخر الکترون جدا کنید.
اگر آرایش الکترونی کاتیونی داده شود و بخواهیم آن را به آرایش الکترونی اتم تبدیل کنیم، کافی است که به تعداد بار و به ترتیب پرشدن زیرلایه ها، به آن الکترون اضافه کنیم.

برای نوشتن آرایش یون منفی، ابتدا آرایش الکترونی اتم مورد نظر را نوشته و سپس به تعداد بار یون به آخرین زیر لایه موجود الکترون اضافه کنید.
اگر آرایش الکترونی آنیونی داده شود و آرایش الکترونی اتم خنثی را بخواهید، کافی است به تعداد بار آنیون، از آخرین زیر لایه موجود در آنیون الکترون کم کنید.

* همهء یون های منفی (آنیون ها) به آرایش پایدار گاز نجیب می رسند، ولی در کاتیون ها، فقط کاتیون های پایدار فلزهای گروه 1، 2 و 3 و آلومینیم به آرایش گاز نجیب می رسند.
توجه: اغلب کاتیون های عنصرهای دستهء d برخلاف عنصرهای دستهء S، بدون رسیدن به آرایش الکترونی گاز نجیب به پایداری می رسند. به طور مثال آهن می تواند یون Fe2+26 تسکیل دهد، اما این یون به آرایش گاز نجیب نمی رسد. البته عنصرهای گروه 3 که به دستهء d تعلق دارند، می توانند با تشکیل یون +3 به آرایش الکترونی گاز نجیب دورهء قبل از خود برسند.
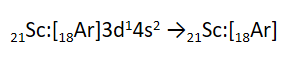
* از آن جا که اتم ها می توانند با از دست دادن یا گرفتن الکترون به آرایش الکترونی گازهای نجیب برسند، نتیجه می گیریم که:
1- آرایش الکترونی ns2 np6 می توانند مربوط به اتم گاز نجیب، یک کاتیون پایدار و یا یک آنیون پایدار باشد.
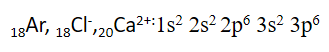
2-آرایش الکترونی 1s2 می توانند مربوط به آرایش یک اتم خنثی (هلیم)، یک یون مثبت (Li+3) و یا یک یون منفی (Li-1) باشد.
* اگر در یک آرایش الکترونی، زیرلایهء 3d وجود داشته باشد ولی زیرلایهء 4s وجود نداشته باشد، آن آرایش الکترونی فقط می تواند، مربوط به یک یون مثبت (کاتیون) باشد. به طور مثال آرایش [18Ar]3d10 فقط می تواند مربوط به یک کاتیون باشد؛ زیرا در اتم های خنثی، زیرلایهء 4s زودتر از زیرلایهء 3d اشغال می شود.
ترکیب های یونی
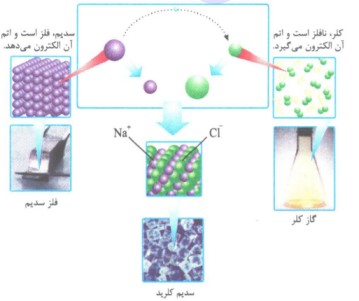
دو نوع اتم که در شرایط مناسب در کنار هم قرار می گیرند، با هم الکترون داد و ستد میکنند، یه طوری که یکی به یون مثبت و دیگری به یون منفی تبدیل می شود. در این مواقع میان یون های تولید شده به دلیل وجود بارهای الکتریکی ناهم نام، نیروی جاذبهء بسیار قوی برقرار می شود که به آن پیوند یونی و به ترکیب حاصل، ترکسی یونی می گویند.
مثال: هرگاه اتم های سدیم و کلر کنار یکدیگر قرار گیرند، اتم سدیم یا از دست دادن یک الکترون به یون سدیم (Na+) و اتم کلر با گرفتن یک الکترون به یون کلرید (Cl-) تبدیل و در این واکنش، ترکیب یونی سدیم کلرید (نمک خوراکی) تشکیل می شود.
با توجه به شکل رو به رو کشف خواهیم کرد:
1- فلز سدیم بسیار نرم است؛ به طوری که با چاقو بریده می شود.
2- گاز کلر، گازی زرد رنگ است.
3- اندازهء (شعاع) یون Na+ از اتم Na کوچک تر و اندازهء ( شعاع) یون Cl- از اتم Cl بزرگ تر است.
* ترکیب های یونی شامل تعداد بسیار زیادی یون با آرایشی منظم هستند که در ساختار آن ها مولکولی وجود ندارد؛ از این رو به کار بردن واژهء مولکول برای آن ها غلطه!
* به کاتیون یا آنیونی که تنها از یک اتم تشکیل شده باشد، یون تک اتمی می گویند؛ مانند -Na+، Cl-، N3 و ....
توجه: هر یونی که از یک نوع اتم تشکیل شده باشد، لزوما تک اتمی نیست؛ به طور مثال یون اکسیژن پراکسید تنها از یک نوع اتم (O) تشکیل شده است، ولی تک اتمی به شمار نمی آید؛ زیرا دارای دو نوع اتم می باشد.
* برای نام گذاری کاتیون های تک اتمی ( که تنها یک نوع بار دارند)، پیش از نام عنصر، کلمهء یون را اضافه می کنیم:
یون روی : +Zn2 یون کلسیم : +Ca2
* برای نام گذاری آنیون های تک اتمی، علاوه بر به کار بردن کلمهء یون قبل از نام آنیون، به انتهای نام نافلز (یا ریشهء نام آن) پسوند «ید» اضافه می کنیم.
یون نیترید:-N3 و یون سولفید: +S2 و یون فلوئورید: -F
* به ترکیب های یونی که تنها از دو عنصر (دو نوع اتم) ساخته اند، مانند NaCl، Al2O3 و ... ترکیب یونی دوتایی می گویند. برای فرمول نویسی ترکیب های یونی دوتایی به صورت زیر عمل می کنیم:
مرحله اول – در سمت چپ، فرمول کاتیون و در سمت راست، فرمول آنیون را می نویسیم.
مرحله دوم – بار کاتیون را به عنوان زیروند آنیون و بار آنیون را به عنوان زیروند کاتیون قرار می دهیم.
مرحله سوم – زیروندها را تا آن جا که ممکن است ساده می کنیم و از نوشتن زیروند 1 خودداری می کنیم.
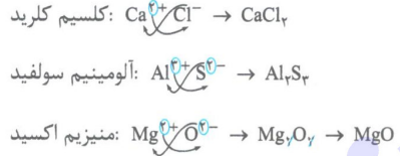
* برای نام گذاری ترکیب های یونی دوتایی، ابتدا نام کاتیون ( بدون ذکر واژهء یون) و سپس نام آنیون (بدون ذکر واژهء یون) را می نویسیم.
آلومینیم فلوئورید: AlF3
* هر ترکیب یونی از لحاظ بار الکتریکی خنثی است؛زیرا مجموع بار الکتریکی کاتیون ها با مجموع بار الکتریکی آنیون ها برابر است.
تبدیل اتم ها به مولکول ها
همان طور که قبلا گفتیم، یکی از روش های رسیدن به آرایش پایدار گاز نجیب، به اشتراک گذاشتن الکترون است. پیوندی که ناشی از به اشتراک گذاشتن الكترون بین دو اتم است، پیوند اشتراکی یا کووالانسی نامیده میشود. در مولکول ها به جای این که الکترون دادوستد شود، الکترون به اشتراک گذاشته می شود.
مثال: گاز کلر که خاصیت رنگ بری و گندزدایی دارد، از مولکولهای دواتمی Cl2تشکیل شده است.
در آرایش الکترون - نقطه ای اتم کلر، یک الکترون جفت نشده وجود دارد؛ بنابراین هر اتم کلر به دنبال آن است که تک الکترون خود را با تک الکترون اتم کلر دیگر به اشتراک بگذارد تا هر دو به آرایش هشت تایی برسند. با تشکیل مولکول Cl2، دو الکترون موجود بین دو اتم، به هر دوی آنها تعلق دارد. به این جفت الکترون اشتراکی، پیوند اشتراکی (کووالانسی) می گویند.
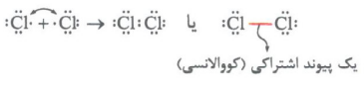
1- به مواد شیمیایی که در ساختار خود مولکول دارند، مواد مولکولی می گویند. این مواد مولکولی هم می توانند به صورت عنصر باشند، مثل Cl2 ,O2و .... و هم به صورت ترکیب، مثل H2O ، HCl و ...
2- پیوند اشتراکی (کووالانسی) معمولا بین اتمهای نافلز تشکیل می شود؛ به طور مثال پیوند بین N و O از نوع اشتراکی است؛ یعنی این دو اتم با هم، ترکیب مولکولی تشکیل میدهند. در حالی که قبلا دیدیم از واکنش یک فلز و یک نافلز، ترکیب یونی تشکیل می شود.
3- هر اتم هیدروژن در لایه ظرفیت خود یک الکترون دارد و نیاز به یک الکترون دیگر دارد تا به آرایش پایدار دوتایی (شبیه هلیم) برسد؛ بنابراین اتم هیدروژن تنها می تواند یک پیوند اشتراکی تشکیل دهد.
4- به پیوند کووالانسی که در نتیجه به اشتراک گذاشتن دو جفت الکترون میان دو اتم تشکیل می شود، پیوند دوگانه می گویند. در پیوند دوگانه (=)، هر خط معادل ۲ الكترون و این پیوند در مجموع معادل ۴ الكترون اشتراکی است.
5- به پیوند کووالانسی که در نتیجه به اشتراک گذاشتن ۳ جفت الکترون میان دو اتم تشکیل می شود، پیوند سه گانه می گویند. این پیوند (≡) در مجموع معادل ۶ الكترون اشتراکی (6=3×2) است.
با توجه به آرایش الکترون - نقطه ای اتم ها، به راحتی می توان آرایش الکترون - نقطهای مولکول های ساده را رسم کرد. آرایش الکترون - نقطه ای همه مولکولهایی که شما در این فصل باید بلد باشید، به این صورت است.
به فرمول شیمیایی مولکلول ها که علاوه بر نوع عنصرهای سازنده، شمار اتم های هر عنصر را نشان می دهد، فرمول مولکولی می گویند؛ به طور مثال فرمول مولکولی آب و آمونیاک به صورتH2O,NH3 می باشد.
تست 1:

تست 2:

تست 3:

دوستان عزیز می توانید برای دسترسی به نسخه کامل خلاصه نکات به همراه پاسخ فایل پی دی اف زیر را دانلود کنید!
فراموش نکنید اگر سوالی در رابطه با این مبحث داشتید می توانید به راحتی در کامنت ها سوال خود را برای ما بنویسید.
دوستان عزیزم؛ برای ارتباط با رتبه برترها صفحه اینستاگرام زیر رو دنبال کنید.
با آرزوی موفقیت و کامیابی


