خلاصه نکات فصل 2 شیمی دوازدهم : آسایش و رفاه در سایه شیمی
الکتروشیمی: شاخه ای از دانش شیمی است که در بهبود خواص مواد و تأمین انرژی نقش بسزایی دارد.
چراغ خورشیدی یک ابزار روشنایی است که از لامپLED ، سلول خورشیدی و باتری قابل شارژ تشکیل شده است.
📌 تعاریف مهم:
کاهش: گرفتن الکترون اکسایش: از دست دادن الکترون
نیم واکنش: شیمی دانها هر یک از فرایندهای گرفتن و از دست دادن الکترون را با کمک یک نیم واکنش نمایش می دهند.
نکته: هر نیم واکنش باید از لحاظ بار الکتریکی و جرم موازنه باشد.
اکسنده: ماده ای که با گرفتن الکترون، سبب اکسایش گونهی دیگر می شود.
کاهنده: مادهای که با از دست دادن الکترون،سبب کاهش گونهی دیگر می شود.
اغلب فلزها در واکنش با نافلزها تمایل دارند که یک یا چند الکترون خود را به نافلز داده و ضمن اکسایش به کاتیون تبدیل شوند در حالی که نافلزها با گرفتن یک یا چند الکترون کاهش یافته و به آنیون تبدیل می شوند.از این رو فلزها اغلب کاهنده و نافلز ها اغلب اکسنده هستند.
اغلب فلزها در واکنش با محلول اسیدها، گاز هیدروژون و نمک تولید می کنند.
اگر به جای داد و ستد مستقیم الکترون بین گونههای کاهنده واکسنده، بتوان الکترونها را طریق یک مدار بیرونی هدایت و جابه جا کرد، آنگاه می توان بخشی از انرژی آزاد شده در واکنش اکسایش – کاهش را به شکل انرژی الکتریکی در دسترس تبدیل نمود.
آند: الکترودی است که در آن نیم واکنش اکسایش انجام میشود و به آن نیم واکنش آندی نیز می گویند.
کاتد: الکترودی است که در آن نیم واکنش کاهش انجام می شود و به آن نیم واکنش کاتدی نیز می گویند.
سلول گالوانی: دستگاهی است که می تواند بر اساس قدرت کاهندگی فلزها انرژی الکتریکی تولید کند.
نکات مهم در رابطه با سلول گالوانی:
با گذشت زمان غلظت کاتیونها در ظرف آندی افزایش ودر ظرف کاتدی کاهش می یابد.
جهت حرکت الکترونها در مدارخارجی از آند به سمت کاتد است.
در سلول گالوانی آنیونها به سمت آند و کاتیونها به سمت کاتد حرکت می کنند.
با گذشت زمان جرم تیغه کاتدی افزایش و تیغه آندی کاهش می یابد.
برای بدست آوردن E0 واکنش کافی است:
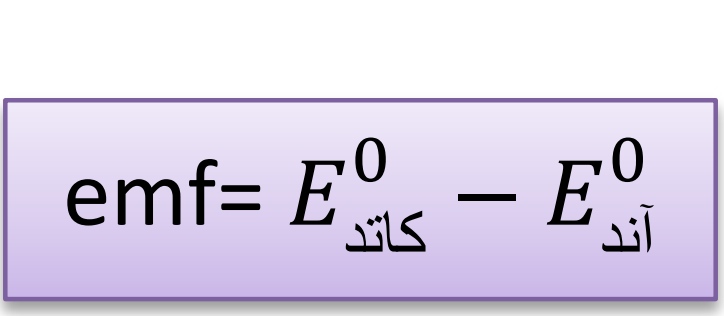
در سلول گالوانی آند قطب منفی و کاتد قطب مثبت سلول را تشکیل می دهد.
نیروی الکتروموتری: ولتاژی است که ولت سنج در سلول گالوانی نشان می دهدو بیانگر اختلاف پتانسیل میان دو نیم سلول میباشد.
اندازه گیری پتانسیل یک نیم سلول به طور جدا گانه ممکن نیست و باید این کمیت به طور نسبی اندازه گیری شود.
به منظور انجام این کار نیم سلول استاندارد هیدروژن به عنوان مبنا انتخاب شده و پتانسیل آن برابر صفر در نظر گرفته میشود.
پتانسیل استاندارد سلول (E0 ): با تشکیل سلول گالوانی،شیمی دانها توانستند پتانسیل بسیاری از نیم سلولها را در دمای °۲۵ سانتی گرا، فشارatm 1وغلظت یک مولار برای محلول الکترولیتها اندازه گیری کرده و آن را پتانسیل استاندار نیم سلول نامیدند.
به رتبه بندی فلزها به ترتیب کاهش پتانسیل استاندارد آنها در یک جدول، سری الکترو شیمیایی می گویند.
لیتیم در ساخت باتریهای دکمهای کاربرد داشته و کمترین چگالی وE0 رادارد.
ویژگیهای سلول سوختی:
1- برای تأمین انرژی خودروها به کار گرفته می شود و نوعی سلول گالوانی است .
2-کارایی بیشتری داشته و ردپای کربن دی اکسید را کاهش می دهد،به همین خاطر منبع انرژی سبز به شمار میآید.
در سلول سوختی هیدروژن-اکسیژن ، هیدروژن در بخشی آندی اکسایش و اکسیژن در بخشی کاتدی کاهش می یابد.
در این سلول خروجی بخش آندی گاز هیدروژن و خروجی بخش کاتدی مولکولهای آب به حالت گازی شکل است.
توجه:عدد اکسایش عناصر به حالت آزاد برابر صفر است وعدد اکسایش یونهای تک اتمی برابر بار الکتریکی آنها است.
سلول الکترولیتی : در این سلول با اعمال یک ولتاژ بیرونی و با عبور جریان الکتریکی از درون محلول الکترولیت می توان یک واکنش شیمیایی را در خلاف جهت طبیعی پیش راند.
در سلول الکترولیتی خود الکترودها در واکنش شرکت نکرده و اغلب گرافیتی هستند.
در این سلول ها کاتد به قطب منفی و آند به قطب مثبت باتری متصل است.
هنگامی که به سلول الکترولیتی ولتاژی اعمال شود ، یونها به سوی الکترودی با بار ناهمنام حرکت می کنند.
در واکنش برقکافت آب ،کاغذ پیرامون محلول آند به رنگ قرمز و پیرامون محلول کاتد به رنگ آبی در می آید.
سلول دانز،یک سلول الکترولیتی است، که در صنعت برای تهیه فلز سدیم به کار می رود.
در این سلول ، یونهای سدیم در سمت منفی (کاتد) کاهش و یونهای کلرید در سمت قطب مثبت (آند) اکسایش می یابند.
به فرایند ترد شدن،خورد شدن و فرو ریختن فلزها در اثر اکسایش- کاهش خوردگی گفته می شود.
پتانسیل کاهشی اغلب فلزها منفی بوده اما پتانسیل کاهشی اکسیژن مثبت است . بنابراین اکسیژن به عنوان اکسنده تمایل دارد با گرفتن الکترون از فلزها آنها را اکسید کند.
واکنش کاهش اکسیژن در محیط اسیدی مثبت تر از کاهش آن در محیط خنثی است.
فلز طلا به دلیل قدرت اکسندگی بسیار بالایی که دارد حتی در هوای مر طوب و در اعماق دریا نیز اکسید نمی شود.
هنگامی که دو فلز در هوای مر طوب با هم در تماس باشند،برای اکسایش یافتن با یکدیگر رقابت کرده وفلزی که پتانسل استاندارد کوچکتری داشته ویا کاهنده تر است در این رقابت برنده می شود.
آهن گالوانیزه (آهن سفید) به ورقههای آهن که با پوششی از فلز روی تهیه شده اطلاق می شود.
حلبی : به پوشاندن ورقه ی آهن با لایه نازکی از قلع گفته می شود که در ساخت قوطیهای کنسروکاربرد دارد.
آبکاری: به پوشاندن سطح یک فلز با لایه ی نازکی از فلزات ارزشمند و مقاوم در برابر خوردگی گفته شده و در یک سلول الکترولیتی انجام می شود.
آیدا مهربان،
رتبه 296 منطقه 2،
دانشجوی پزشکی دانشگاه علوم پزشکی شهید بهشتی
برای رزرو مشاوره و رفع اشکال درسی و شرکت در کلاس های کنکوری با مشاوران سایت برترها بر روی لینک زیر کلیک کنید یا با شماره تماس 0216463 داخلی1174(حیدریان) تماس بگیرید.
مطالب مرتبط:
اسیدها و بازها-شیمی دوازدهم-آیدا مهربان
اکسایش و کاهش-شیمی دوازدهم-آیدا مهربان
هعع8عللغبرای رزرو مشاوره و رفع اشکال درسی و شرکت در کلاس های کنکوری با مشاوران سایت برترها بر روی لینک زیر کلیک کنید یا با شماره تماس 0216463 داخلی1174(حیدریان) تماس بگیرید.

