به نام خدا
درسنامه فصل دوم شیمی دوازدهم، مبحث آسایش و رفاه در سایه شیمی
قوانین عدد اکسایش:
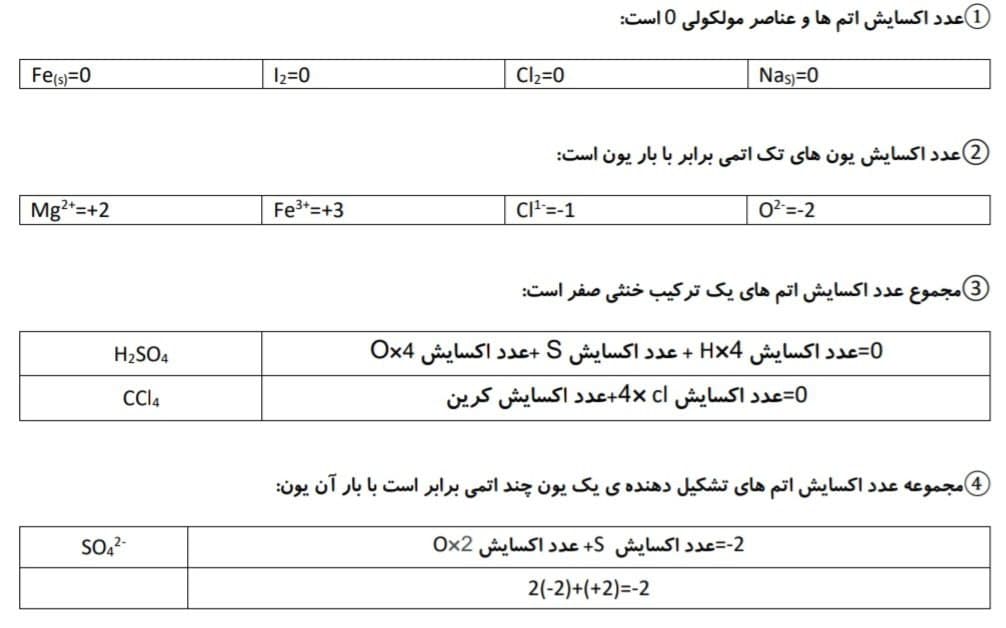
⑤عدد اکسایش F همواره -1 است ( در عنصر F2 عدد اکسایش F ، 0 است)
⑥عدد اکسایش O معمولا -2 است.
- در پراکسید ها (O2-2) عدد اکسایش هر یک از اتم های اکسیژن -1 است.
- در OF2 عدد اکسایش اتم اکسیژن +2 است.
- ⑦ عدد اکسایش H معمولا 1+ است.در مولکول H2 عدد اکسایش اتم هیدروژن صفر است.
در ترکیب هیدروژن با فلزها : در NaH عدد اکسایش هیدروزن 1- است، در Cah2 عدد اکسایش هیدروژن 1- است.
افزایش عدد اکسایش← اکسایش یافتن
کاهش عدد اکسایش ← کاهش یافتن
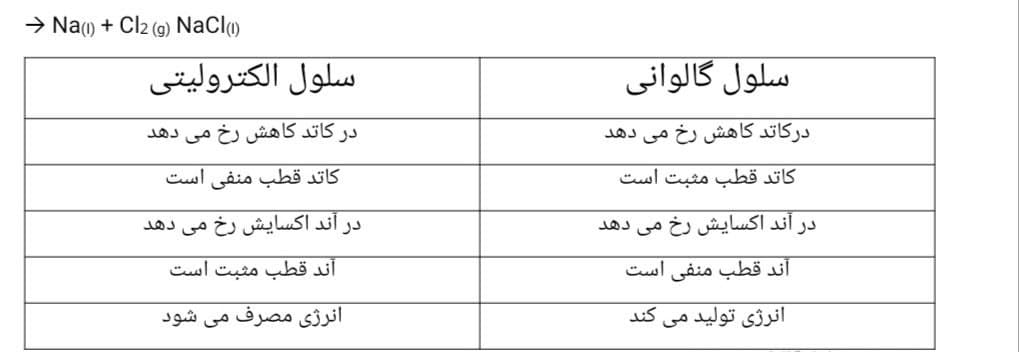
سلول گالوانی:
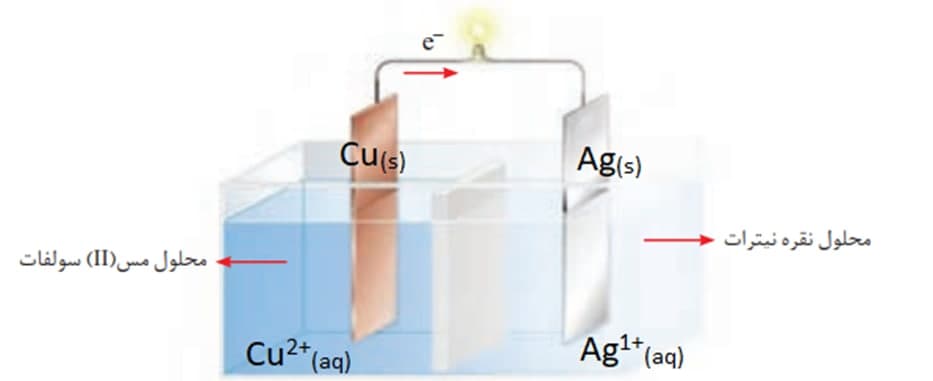
در سلول گلوانی مس-نقره :
1-اتم های مس الکترون از دست می دهند :اکسایش می یابند:
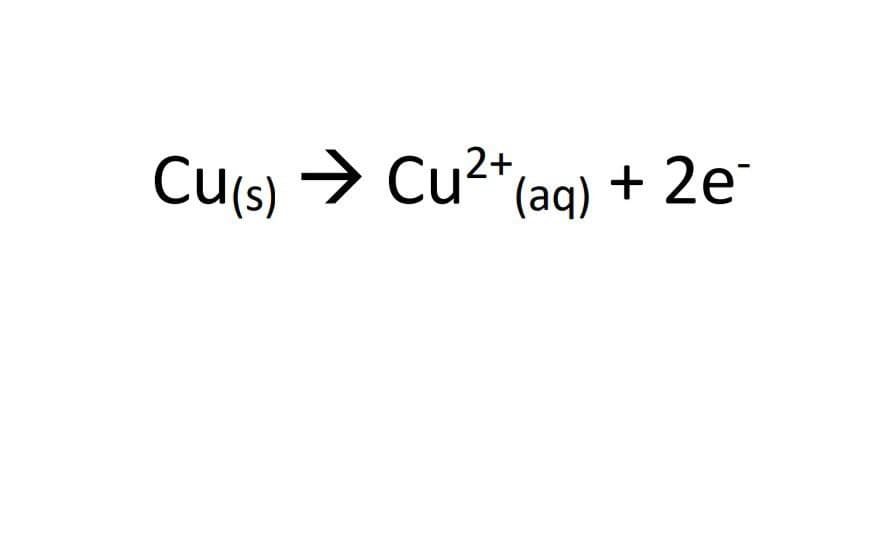
2-الکترون ها از طریق سیم از محلول مس (II) سولفات به محلول نقره نیترات می روند.
3-یون های نقره الکترون دریافت می کنند : کاهش می یابند:
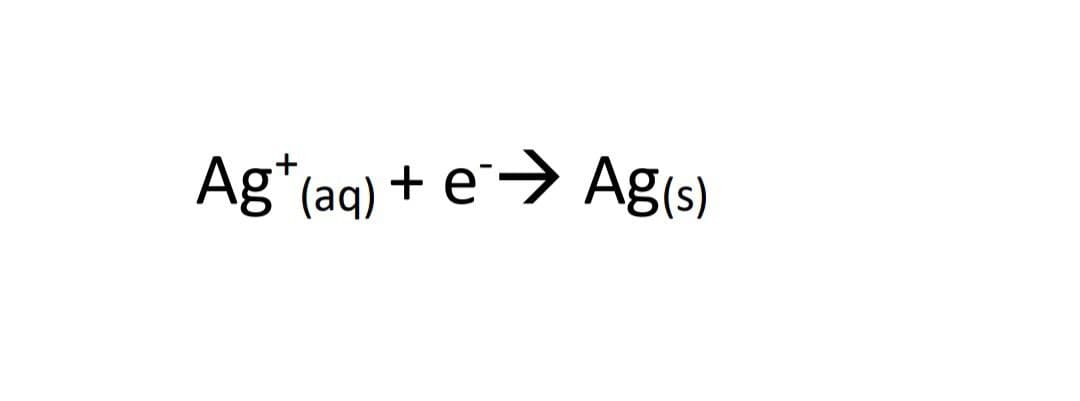
الکترود مس را که الکترون تولید می کند آند می نامند و علامت آن - است
الکترود نقره که الکترون ها را مصرف می کند کاتد می نامند و علامت آن + است.
یون های مثبت Ag+ و Cu2+ به سمت کاتد حرکت می کنند.
(جهت حرکت الکترون ها و کاتیون های محلول یکسان است)
جهت جریان از – به + است.
سلول گالوانی بر اساس قدرت کاهندگی فلزات انرژی الکتریکی تولید می کند میزان این انرژی با اختلاف پتانیل دو نیم سلول کاتدی و آندی برابر است کمیتی که به نیروی الکتروموتوری معروف است و باemf نشان داده می شود.
شیمی دان ها نیم سلول استاندارد هیدروژن SHE را در نظر گرفته و پتانسیل سایر عناصر را نسبت به آن می سنجند:
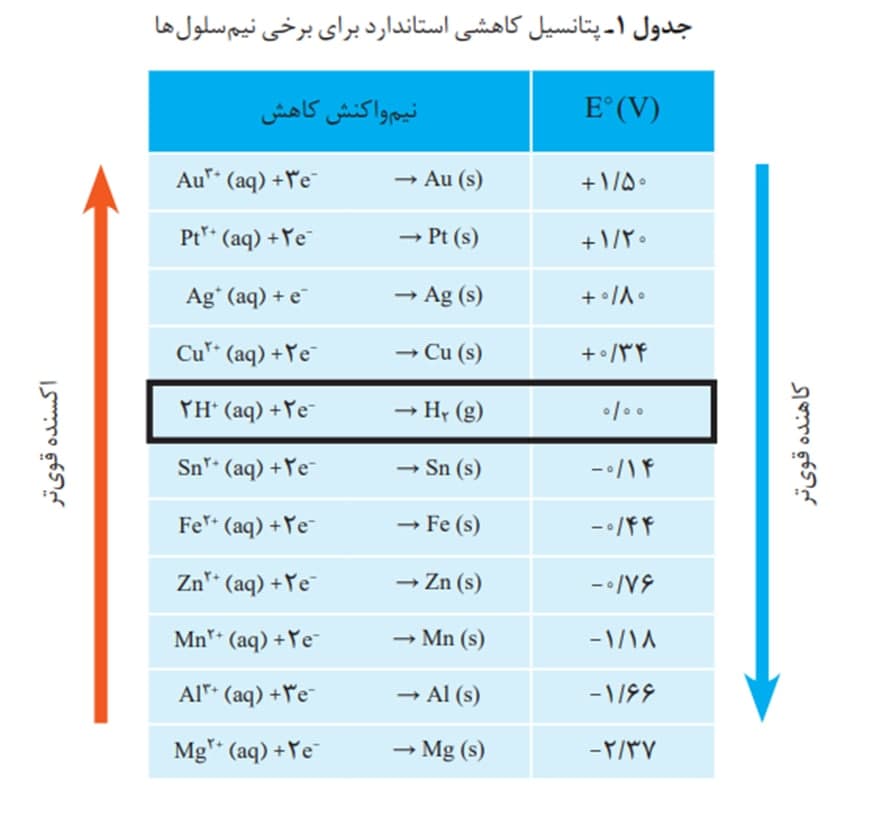
هر چه پتانسیل عنصری بالاتر باشد تمایل کمتری به از دست دادن الکترون دارد در نتیجه کاتیون های آن تمایل بیشتری به گرفتن الکترون دارند ← کاتیون های آن آسان تر کاهش می یابند ← اکسنده ی قوی تری است.
هر چه پتانسیل عنصری پایین تر باشد تمایل بیشتری به از دست دادن الکترون دارد در نتیجه اتم های آن راحت تر الکترون از دست می دهند و ← اتم های آن راحت تر اکسایش می یابند ← کاهنده ی قوی تری است.
֎واکنش دو نیم سلول زمانی انجام می شود و سلول گالانی تشکیل می شود که کاتد آن اکسنده تر و آند آن کاهنده تر باشد: به عبارتی در جدول پتانسیل کاهشی کاتد بالاتر و آند پایین تر باشد
֎عناصری که در جدول پتانسیل کاهشی بالاتر از هیدروژن هستند با H+ واکنش نمی دهند به عبارتی در ظرف اسید هایی چون Hcl نگه داری می شوند.
֎اختلاف پتانسیل های دو نیم سلول نسبت به SHE با emf سلول گالوانی برابر است
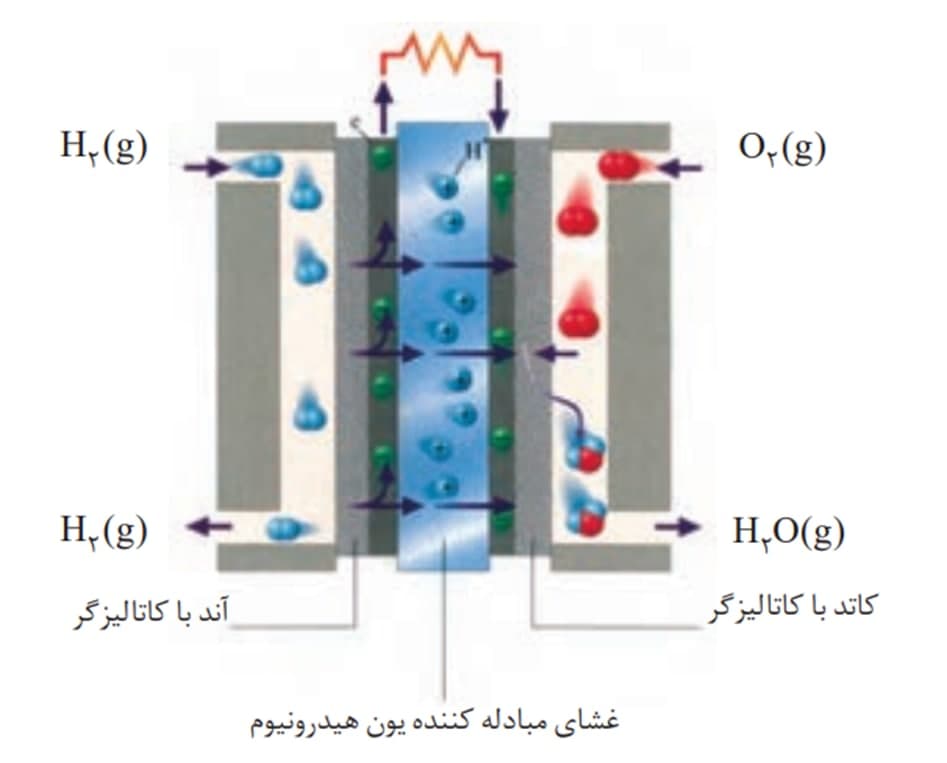
1-مولکول های هیدروژن وارد سلول سوختی می شوند
2-مولکول هیدروژن اکسایش می یابد و الکترون آزاد می کند.
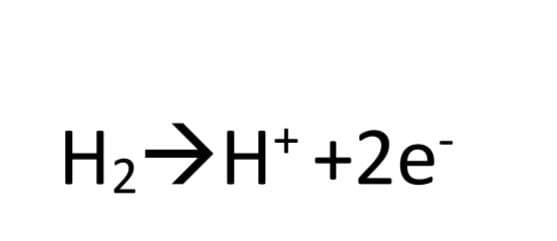
3-الکترون ها از کحل تولید خود (آند ) به سمت محل مصرف خود (کاتد) حرکت می کنند.یون های H+ نیز از غشای مبادله کننده ی یون هیدرونیوم عبور کرده و به سمت کاتد می روند.
4-در کاتد مولکول های لکسیژن الکترون ها را می گیرند و کاهش می یابند:
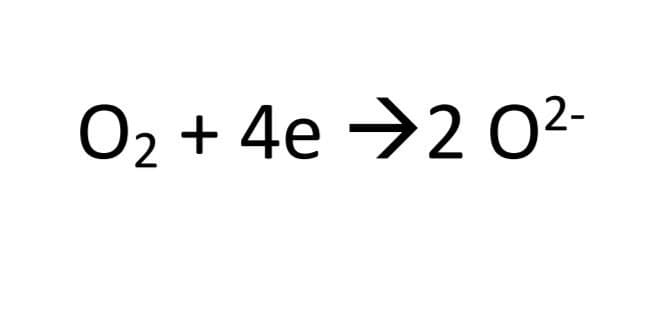
5-از واکنش یون های هیدرونیوم و o2- مولکول های آب ساخته می شود.
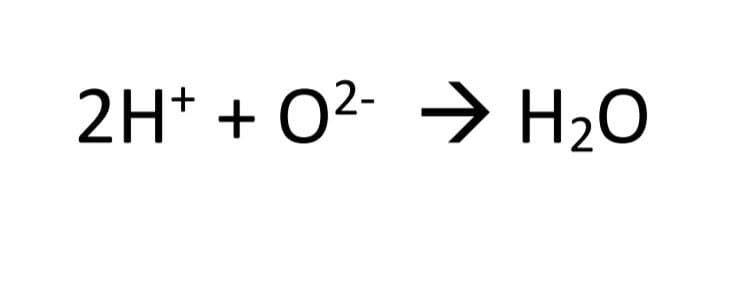
پس واکنش کلی سلول سوختی را می توان به شکل زیر نوشت:
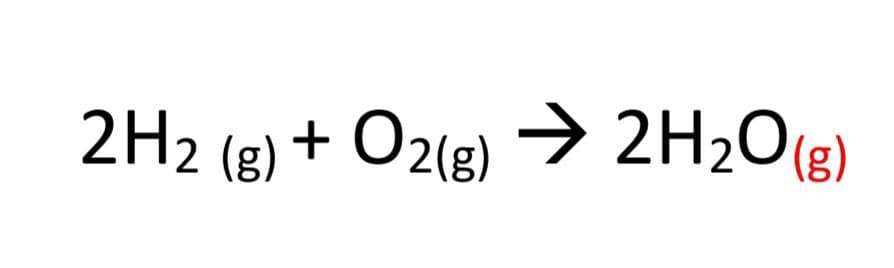

برقکافت آب در سلول الکترولیتی انجام می شود.در سلول الکترولیتی برخلاف گالوانی انرژی تولید نمی شود بلکه مصرف می شود.
1-در آند اکسایش رخ می دهد و الکترون تولید می شود.قطب آند در سلول الکترولیتی + است.
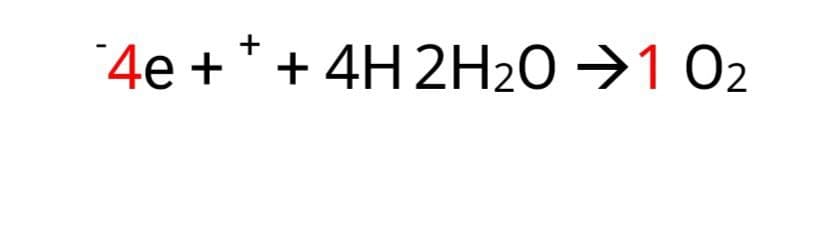
اطراف آند اسیدی است.زیرا یون هیدرونیوم تولید می شود.
2-در کاتد کاهش رخ می دهد و الکترون مصرف می شود.قطب کاتد در سلول الکترولیتی – است.
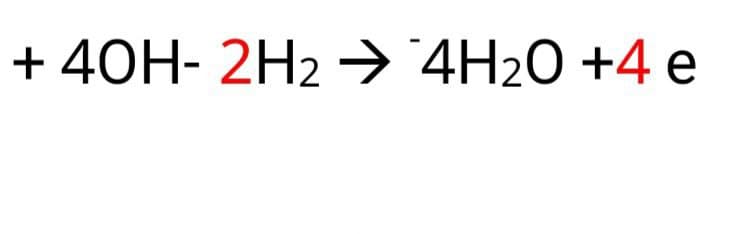
اطراف کاتد بازی است زیرا یون هیدروکسید تولید می شود.
با یکسان گرفتن تعداد الکترون ها در دو نیم واکنش مشاهده می شود که میزان هیدروژن تولیدی در کاتد دو برابر اکسیژن تولید در آند است( اختلاف ارتفاع هوا در دو لوله)
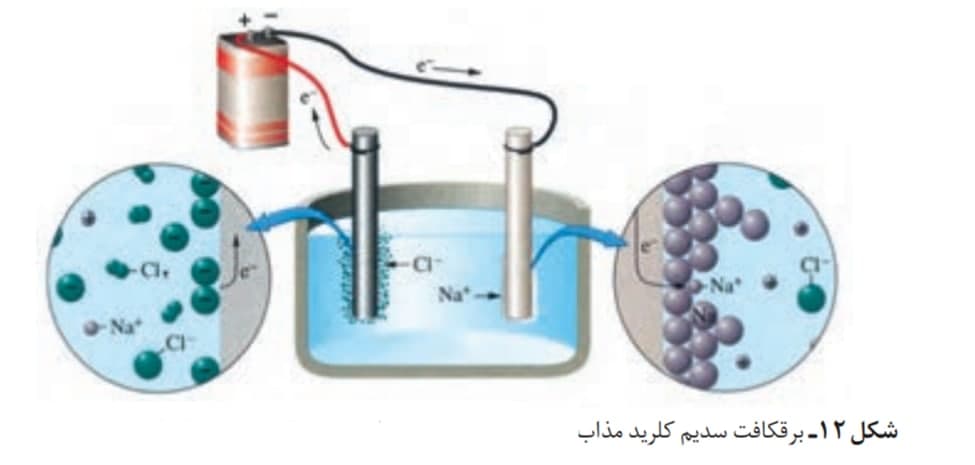
در این برقکافت از NaCl مذاب استفاده می شود.
1-یون های سدیم در کاتد ، کاهش می یابند و الکترون مصرف می کنند.
2-یون های کلرید در آند اکسایش می یابند و گاز کلر تولید می شود

گزینه 3
گزینه 1-در سلول گالوانی انرژی شیمیایی به الکتریکی تبدیل می شود.گ
گزینه 2-یون ها از غشای متخلل عبور می کنند به طوری که کاتیون ها به سمت کاتد آنیون ها به سمت آند می روند.
گزینه 4-اند محل اکسایش و کاتد محل کاهش است.
-

گزینه 2
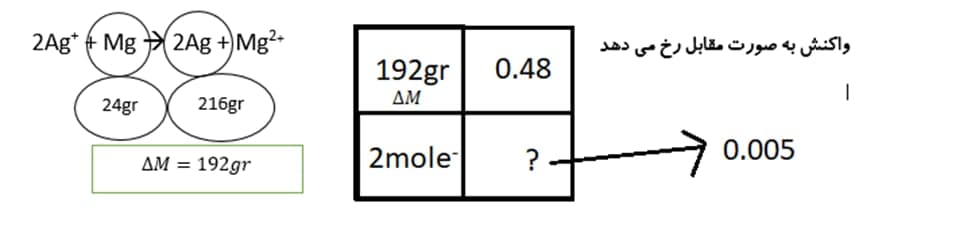
واکنش به صورت مقابل رخ می دهد

گزینه 4
بازدهی سوختن گاز هیدروژن در سلول سسوختی تقریبا سه برابر سوختن آن در موتور درون سوز است.

گزینه 1

برای رزرو مشاوره و رفع اشکال درسی و شرکت در کلاس های کنکوری با مشاوران سایت برترها بر روی لینک زیر کلیک کنید یا با شماره تماس 0216463 داخلی1174(حیدریان) تماس بگیرید.

