باسلام خدمت دوستان کنکوری1401
این مطلب شامل درسنامه و تست مبحث درسنامه و تست مبحث سلول گالوانی و پتانسیل کاهشی استاندارد شیمی دوازدهم هست که توسط هما پرتوانداز، رتبه 226تجربی و 289زبان منطقه 2کنکور سراسری99و دانشجوی پزشکی دانشگاه علوم پزشکی ایران تهیه شده است.

باماهمراه باشید:)
درسنامه درس شیمی منطبق با آزمون 19آذر
برای ایجاد جریان الکتریکی باید الکترون ها را از یک مسیر معین عبور داد یا از نقطه ای به نقطه دیگر جابه جا نمود. اگر به جای داد و ستد مستقیم الکترون بین گونه های اکسنده و کاهنده در یک واکنش، بتوان الکترون ها را از طریق یک مدار بیرونی هدایت و جابه جا کرد آنگاه می توان بخشی از انرژی آزاد شده در واکنش اکسایش ــ کاهش را به شکل انرژی الکتریکی در دسترس تبدیل نمود. شیمی دان ها در پژوهش ها دریافتند که هرگاه تیغه روی درون محلولی از روی سولفات (نیم سلول روی) و تیغه مس درون محلولی از مس IIسولفات (نیم سلول مس)قرار گیرد و نیم سلول ها همانند شکل زیر به یکدیگر وصل شوند، الکترون ها در مدار بیرونی جابه جا شده و جریان الکتریکی ایجاد می شود. جریانی که سبب روشن شدن لامپ خواهد شد. نتایج حاصل از چنین پژوهش هایی منجر به ساخت سلول گالوانی شد.
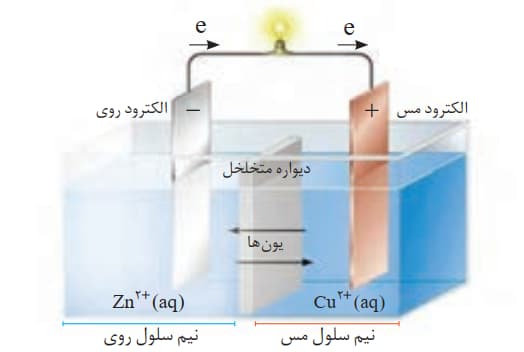
به مجموعه ای که شامل یک تیغه فلزیM (الکترود)در محلولی از کاتیون های +Mn(محلول الکترولیت)قرار داده شده است,نیم سلول می گویند.
نکته:در نیم سلول,یک رسانای الکترونی(تیغه فلزی)در تماس با یک رسانای یونی (محلول الکترولیت)قرار دارد.
نکته:در یک سلول گالوانی,فلزی که الکترون دهنده تر(کاهنده تر)است,واکنش اکسایش و کاتیون فلزی که قدرت کاهندگی کمتری دارد,نیم واکنش کاهش را انجام می دهد.
در سلول گالوانی=>اتد(محل فرآیند کاهش)← قطب مثبت(+)
=>آند(محل فرآیند اکسایش)← قطب منفی(-)
نکته: در مداربیرونی,الکترون ها از قطب منفی(آند)به سمت قطب مثبت(کاتد)حرکت می کنند.
نکته: از طریق دیواره متخلخل کاتیون ها به سمت کاتد و آنیون ها به سمت آند حرکت می کنند تا حالت خنثی در هر دو نیم سلول حفظ شود.
نکته: فلز فعال تر,آند سلول است.
اگر در سلول گالوانی به جای لامپ، ولت سنج قرار گیرد، ولتاژی که ولت سنج نشان می دهد، اختلاف پتانسیل میان دو نیم سلول است. کمیتی که به نیروی الکتروموتوری معروف است و با emfنمایش داده میشود.
اندازه گیری پتانسیل یک نیم سلول به طور جداگانه ممکن نیست و باید این کمیت به طور نسبی اندازه گیری شود. شیمی دان ها برای دستیابی به این هدف، نیم سلول استاندارد هیدروژن(SHE) به عنوان مبنا انتخاب کردند و پتانسیل آن را برابر با صفر در نظر گرفتند. در ادامه با تشکیل سلول گالوانی از هر نیم سلول با SHEتوانستند پتانسیل بسیاری از نیم سلولها را اندازهگیری کرده و در جدولی ثبت کنند .این اندازه گیری ها در دمای ،C°25فشار 1atmو غلظت یک مولار برای محلول الکترولیت ها انجام شده است. در این شرایط پتانسیل اندازه گیری شده را پتانسیل استاندارد نیم سلول مینامند و با °Eنمایش میدهند.
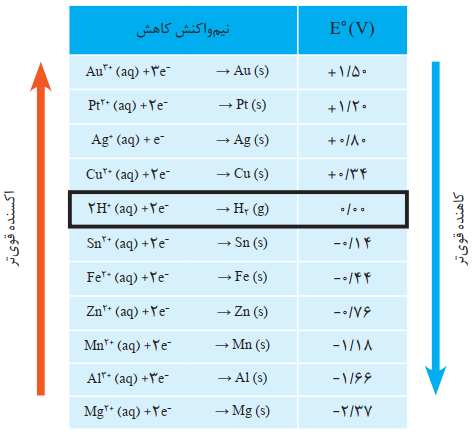
همانگونه که مشاهده می کنید در این جدول، نیم واکنش ها به شکل کاهش نوشته شده اند و این پیشنهاد آیوپاک برای هماهنگی در همه منابع علمی معتبر به کار می رود. در هر نیم واکنش، گونه کاهنده در سمت راست و گونه اکسنده در سمت چپ نوشته می شود. در این جدول علامت ° Eفلزهایی که قدرت کاهندگی بیشتری از H2دارند، منفی و علامت °Eفلزهایی که قدرت کاهندگی کمتری از H2دارند، مثبت است.
نکته 1: هر چه عنصری در موقعیت بالاتری از جدول باشد(°𝐸 مثبت تر,)کاتیون آن تمایل بیشتری به گرفتن الکترون دارد و قدرت اکسندگی(تمایل به کاهش)در آ« بیشتر است.
نکته 2: هر چه عنصری در موقعیت پایین تری از جدول باشد(°𝐸 منفی تر)گونه سمت راست(فلز خنثی) تمایل بیشتری به از دست دادن الکترون دارد و قدرت کاهندگی (تمایل به اکسایش)در آن بیشتر است.
نکته 3: فلزهایی که °𝐸 مثبت دارند,نسبت به هیدروژن کاهنده های ضعیف تری هستند و با اسیدها(H+) واکنش نمی دهد
نکته 4: فلزهایی که°𝐸 منفی دارند,نسبت به هیدروژن کاهنده های قوی تری هستند و با اسیدها واکنش می دهند.
تست135)


تست 139)


تست170)



صفحه اینستاگرام تجربی گروه برترها
برای رزرو مشاوره و رفع اشکال درسی و شرکت در کلاس های کنکوری با مشاوران سایت برترها بر روی لینک زیر کلیک کنید یا با شماره تماس 0216463 داخلی1174(حیدریان) تماس بگیرید.
مطلب دیگر از هماپرتوانداز:


