سلام خدمت دوستان کنکوری 1401
این مطلب شامل نکات طلایی درس فصل1و2 شیمی دوازهم مطابق با آزمون 19 آذرهست که توسط خانم سعیده محبی، رتبه 8منطقه1 و 14 کشوری کنکور تجربی؛ دانشجوی رشته پزشکی دانشگاه تهران تهیه شده است. در ضمن درصد ایشون در درس شیمی کنکور ۸8/۷ بوده:)

باما همراه باشید.
نکات مهم شیمی دوازدهم آزمون 19 آذر
در آب دریا و مناطق کویری مقادیر چشمگیری از یون های (نه اتم های) کلسیم و منیزیم وجود دارد.
برای افزایش خاصیت ضدعفونی کنندگی و میکروب کشی صابون ها به آن ها ماده شیمیایی کلردار (نه خود کلر) اضافه می کنند.
خاصیت اسیدی محلول ها به pH آن بستگی دارد.
قدرت اسیدی محلول ها به Ka آن بستگی دارد.
Ka اسید تنها به دما بستگی دارد و با تغییر غلظت محلول در دمای ثابت تغییر نمی کند.
در دمای اتاق (نه هر دمایی )pH محلول های آب بین 0 تا 14 است.
آمونیاک باز ضعیف است که در شیشه پاک کن از آن استفاده می شود.
سدیم هیدروکسید باز قوی است که در لوله بازکن ها استفاده می شود.
گل ادریسی در محیط های اسیدی آب رنگ و در محیط های بازی سرخ است.
اکسنده ترین نافلز که همان فلوئور است واکنش پذیرترین نافلز است اما کاهنده ترین فلز که همان لیتیم است واکنش پذیرترین فلز نیست.
فلزات اغلب (نه همواره) کاهنده و نافلزات اغلب (نه همواره) اکسنده هستند.
اغلب (نه همه) فلزها در واکنش با نافلزها تمایل دارند یک یا چند الکترون خود را به نافلزها داده و ضمن اکسایش به کاتیون تبدیل شوند.
واکنش های اکسایش کاهش به طور همزمان رخ می دهند .
اغلب فلزات (نه همۀ آن ها) در واکنش با محلول اسیدها گاز هیدروژن و نمک تولید می کنند. فلزاتی که E0 مثبت دارند با اسیدها واکنش نمی دهند.
در همۀ واکنش های اکسایش کاهش الکترون داد و ستد می شود اما تنها در برخی از آن ها انرژی آزاد می شود (گرماده) و برخی دیگر گرماگیر هستند.
در گذشته از نور سفید خیره کننده واکنش سوختن منیزیم به عنوان منبع نور عکاسی استفاده می شد. این واکنش نوعی واکنش اکسایش کاهش است که منیزیم در آن اکسایش یافته و اکسیژن کاهش می یابد بنابراین منیزیم کاهنده و اکسیژن اکسنده است.
با استفاده از سلول های گالوانی می توان تنها بخشی از (نه همۀ) انرژی آزاد شده در واکنش اکسایش – کاهش به انرژی الکتریکی در دسترس تبدیل کرد.
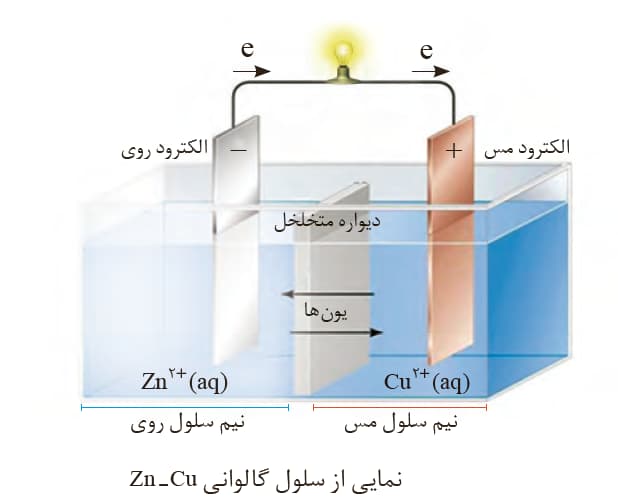
در سلول گالوانی آند الکترودی است که در آن اکسایش رخ می دهد و قطب منفی سلول است.
در سلول گالوانی و کاتد الکترودی است که در آن کاهش رخ می دهد و قطب مثبت سلول است.
در برخی از (نه همۀ) سلول های گالوانی جرم تیغه آند کاهش و جرم تیغه کاتد افزایش می یابد. در سلول سوختی هیدروژن – اکسیژن که نوعی سلول گالوانی است کاهش و افزایش جرم تیغه آندی و کاتدی نداریم.
اگر دیواره متخلل سلول گالوانی حذف شود همچنان واکنش اکسایش کاهش ادامه می یابد اما دیگر نمی توان پتانسیل آن سلول را محاسبه کرد.
شیمی دان ها پتانسیل نیم سلول استاندارد هیدروژن ( SHE) را صفر در نظر گرفتند (آن را صفر محاسبه نکردند.)
اندازه گیری پتانسیل سلول ها در دمای 25درجه سانتی گراد ، فشار 1 atm و غلظت یک مولار است. این شرایط را باSTP اشتباه نگیرید در شرایطSTPدما صفر درجه سلسیوس و فشار 1 اتمسفر است.
در سری الکتروشیمیایی نیم واکنش ها به صورت کاهشی نوشته شده است و گونه های سمت چپ اکسنده و گونه سمت راست کاهنده است.
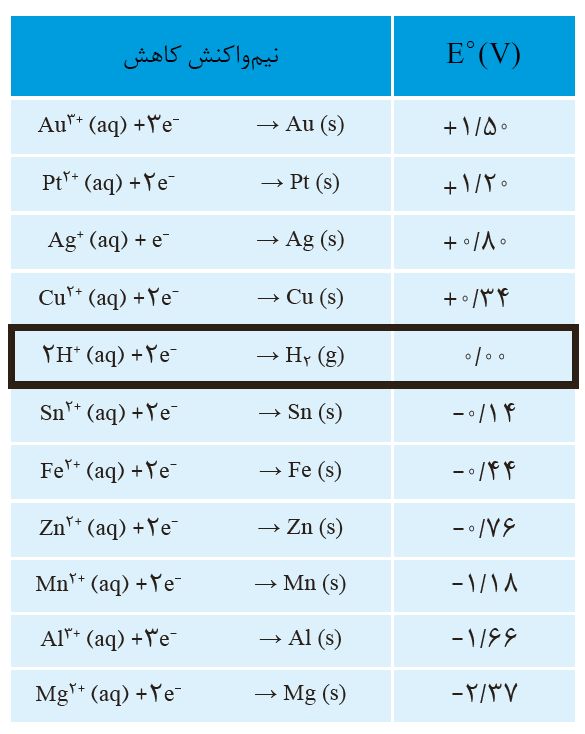
قدرت اکسندگی برای کاتیون های فلز قابل سنجش است. (نه برای اتم های فلز) زیرا اتم های فلز توانایی گرفتن الکترون ندارند.
لیتیم در میان فلزات (نه همۀ عناصر) کمترین چگالی و E0را دارد و از آن در ساخت باتری های دگمه ای استفاده می شود.
باتری های لیتیمی که در رایانه و تلفن همراه به کار می روند قابل شارژ هستند و در آن ها واکنش های برگشت پذیر رخ می دهد.
باتری های لیتیمی نباید در طبیعت دفن یا رها شوند زیرا محیط زیست را آلوده می کنند بلکه باید آن ها را بازیافت کرد به علت اینکه دارای مقدار قابل توجهی از مواد و فلزات ارزشمند هستند.
تست 1:


تست 2:


صفحه اینستاگرام تجربی گروه برترها
برای رزرو مشاوره و رفع اشکال درسی و شرکت در کلاس های کنکوری با مشاوران سایت برترها بر روی لینک زیر کلیک کنید یا با شماره تماس 0216463 داخلی1174(حیدریان) تماس بگیرید.


